清华大学生物医学交叉研究院王晓东团队揭示程序性坏死细胞激活自身Ifnb表达的机制
2025/07/08
程序性坏死是一种裂解性细胞死亡途径,通过破坏细胞膜并释放炎性细胞内容物引发炎症。多种信号通路可激活程序性坏死。RIPK1、TRIF和ZBP1均含有受体相互作用蛋白同型作用基序(RHIM),可通过此结构域结合并激活下游蛋白RIPK3。激活的RIPK3进一步磷酸化MLKL,形成磷酸化MLKL(pMLKL)。pMLKL对带负电的磷脂具有亲和性,其寡聚体与细胞膜负电磷脂结合并打孔,导致细胞膜破损及细胞死亡。有研究发现,程序性坏死细胞中同时存在细胞膜修复机制:膜结合的pMLKL可通过Flotillin介导的内吞作用与ESCRT介导的外排作用被移除,从而抑制细胞膜破损。然而,细胞中累积的pMLKL是否还具有其他生物学功能,尚不清楚。
7月3日,清华大学生物医学交叉研究院王晓东实验室在《分子细胞》(Molecular Cell)杂志上以封面论文形式发表了题为“MLKL在诱导坏死下垂时通过释放线粒体DNA激活cGAS-STING通路”(MLKL activates the cGAS-STING pathway by releasing mitochondrial DNA upon necroptosis induction)的研究。研究发现,在程序性坏死细胞中,I型干扰素表达上调,其中Ifnb上升最为显著。敲除程序性坏死关键蛋白RIPK1、RIPK3或MLKL可完全抑制Ifnb表达,且此效应独立于细胞膜破损。
细胞内Ifnb表达主要依赖于TBK1-IRF3信号轴的激活。在该程序性坏死体系中,可能有两种途径激活TBK1:第一,RIG-I/MDA5识别胞质双链RNA后,通过下游MAVS蛋白激活TBK1;第二,cGAS识别胞质双链DNA后,通过STING激活TBK1。研究人员发现,敲除MAVS不影响Ifnb表达,而敲除cGAS则显著降低Ifnb表达。进一步敲低cGAS下游蛋白STING或TBK1虽不影响程序性坏死进程,但均能抑制Ifnb表达。这些结果表明,程序性坏死细胞中Ifnb表达上调是由cGAS-STING信号通路激活介导的。
cGAS是胞质游离双链DNA感受器,可识别病毒、线粒体或核基因组来源的DNA。为探究程序性坏死中何种DNA激活了cGAS,研究人员分离了细胞的胞质组分(cytosol)。qPCR检测显示,胞质中游离的核基因组DNA含量基本不变,而线粒体DNA(mtDNA)含量显著增加。免疫荧光结合超分辨成像显示,诱导程序性坏死后,mtDNA从线粒体内部移出至线粒体外或限制于线粒体外膜。在线粒体DNA缺失的ρ0细胞中,程序性坏死仍能发生,但由于缺乏胞质游离mtDNA,Ifnb表达被抑制。
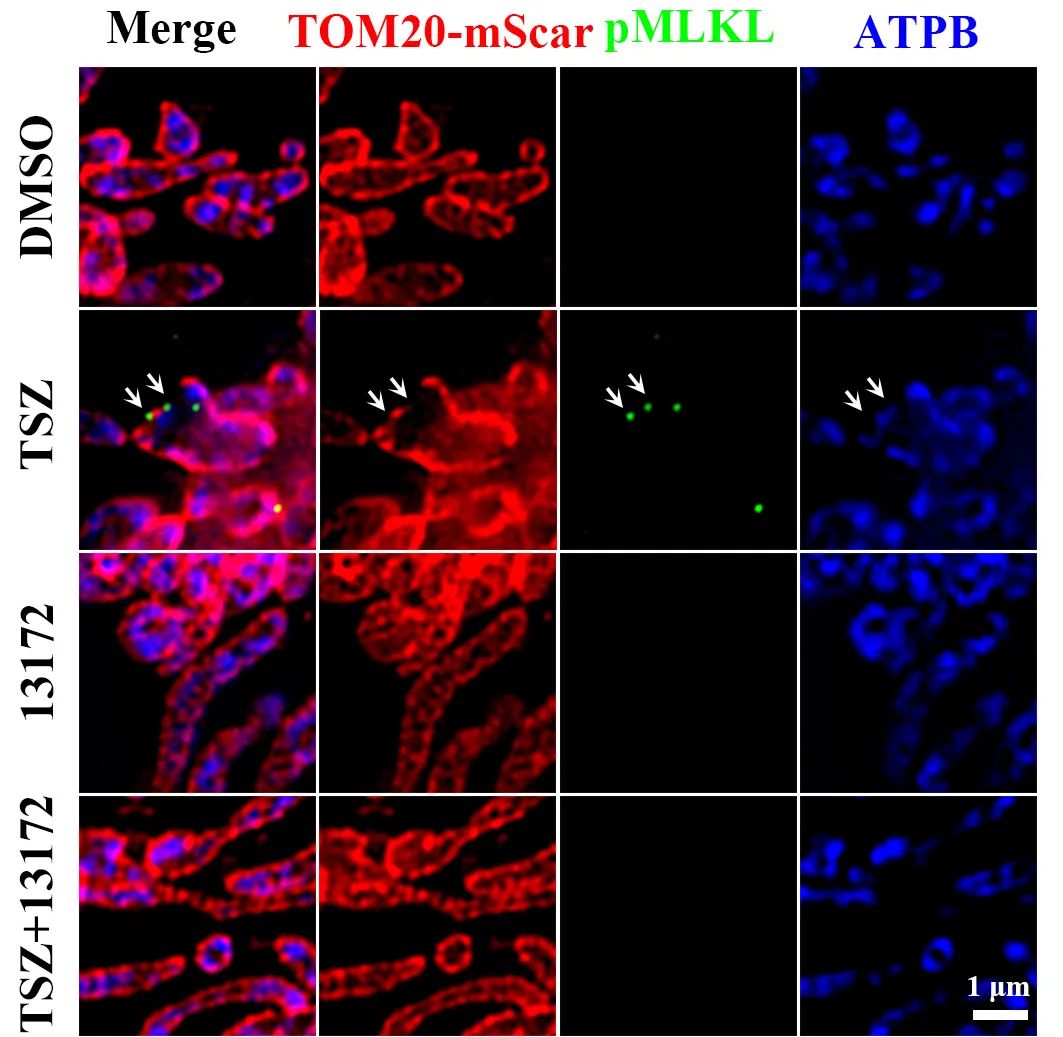
多种线粒体应激压力可导致mtDNA释放,例如线粒体内核酸酶EndoG缺失或mtDNA结合蛋白TFAM缺失等。然而程序性坏死细胞中这些蛋白并未减少。mtDNA释放的可能途径包括线粒体通透性转换孔(mPTP)、VDAC寡聚化孔、Gasdermin家族蛋白或Bax/Bak等。但mPTP和VDAC寡聚化的抑制剂均不能抑制此mtDNA释放。由于程序性坏死诱导体系中Z-VAD-fmk的存在,Gasdermin不会被切割活化。Bax/Bak双敲除细胞也不能抑制程序性坏死中的mtDNA释放。最终,研究人员确定寡聚的pMLKL是执行mtDNA释放的关键。pMLKL寡聚化抑制剂13172可抑制mtDNA释放。在线粒体膜开口处也观察到了pMLKL的共定位。在纯化的线粒体组分中检测到pMLKL富集。线粒体膜富含带负电的心磷脂,而MLKL对心磷脂具有高亲和性。PLSCR3是负责将心磷脂从线粒体内膜转运至外膜的翻转酶,其缺失可抑制程序性坏死导致的mtDNA释放。
图1.寡聚pMLKL定位于线粒体外膜开口
为探究mtDNA释放过程是否受调控,研究人员通过小规模化合物筛选发现微管完整性起关键作用。稳定微管结构的小分子不影响mtDNA释放,而破坏微管结构的小分子则显著抑制其释放。免疫荧光结果显示,微管结构破坏后,程序性坏死细胞内的线粒体虽发生分裂,但mtDNA仍被线粒体外膜包裹,不会释放到胞质。然而微管结构的完整性并不影响pMLKL在线粒体上的富集。
部分极早发性炎症性肠病(IBD)患者因Caspase8蛋白表达降低而导致肠上皮细胞发生程序性坏死。研究人员构建了肠上皮特异性诱导敲除Caspase8的小鼠模型。注射他莫昔芬诱导后,小鼠出现肠炎症状,包括肠上皮损伤、中性粒细胞浸润和肠上皮杯状细胞减少等。在肠上皮细胞中同时敲除RIPK3或MLKL,可完全抑制由程序性坏死引发的肠炎症状。透射电镜在肠上皮细胞中观察到破损的线粒体,分离的肠上皮细胞胞质中游离mtDNA也显著增加。荧光原位杂交显示IBD小鼠肠上皮中Ifnb表达显著升高,干扰素刺激基因产物IFI44蛋白水平也增加。注射STING抑制剂H-151可降低肠上皮细胞中Ifnb表达和IFI44蛋白水平,减少中性粒细胞浸润,并加速炎症消退。
图2.IBD肠上皮细胞线粒体破损伴随Ifnb表达增加
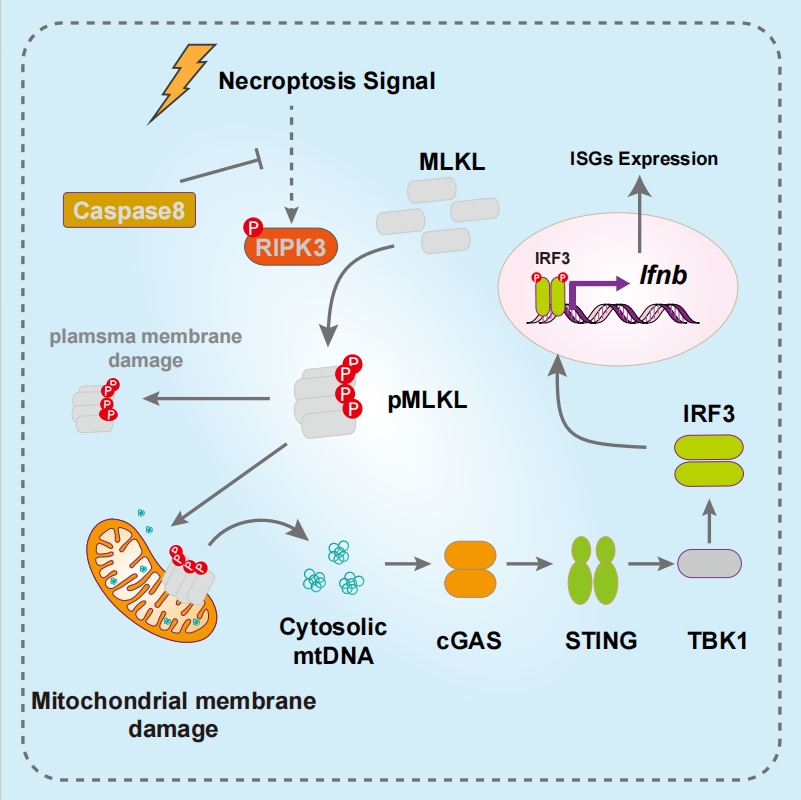
图3.程序性坏死细胞激活自身Ifnb表达的机制
综上,研究团队发现,在程序性坏死过程中,pMLKL除了破坏细胞膜外,还会导致线粒体膜破损并释放mtDNA,进而激活cGAS-STING通路,诱导Ifnb表达。在程序性坏死诱发的小鼠IBD模型中,STING抑制剂能加速肠道炎症消退。该研究深化了对程序性坏死的理解,并对IBD治疗具有积极意义。
清华大学生物医学交叉研究院王晓东实验室的丁璋诚博士为论文第一作者,王晓东研究员为论文通讯作者。
文章来源清华大学,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
北京农科博研技术研究院 24163

-
山东大学文学与新闻传播学院 24236

-
中国国际经济发展促进会 18848

-
上海宜星文化传播有限公司 2278

-
浙江信诺科技有限公司 18316

-
新疆光大旅行社 18281

-
超飞巨英合特会展公司 18319

-
沈阳湛和文化传播有限公司 23130

-
中科云畅应用技术研究院 23263

-
澳門大學 24250

-
武汉科严文化发展有限公司 2076

-
北京四通博大 18129

-
沈阳市平通高薪 21389

-
海南红帆会展服务有限公司 18213

-
中华医学会杂志社 18283

-
重庆邮电大学 21224

-
北京乾圆国学文化研究院 8111

-
杭州新西湖会展有限公司 18148

-
北京中外视觉艺术院 1768

-
百奥泰WCO-2015 23088



















 203
203