生命科学学院高宁课题组揭示真核生物新生肽链共翻译折叠机制
2024/04/23
核糖体催化的蛋白质生物合成是细胞中最精密、最关键的生命活动之一。在肽链延伸过程中,柔性的尚未折叠的新生肽链有错误折叠和引发蛋白质聚集的风险,折叠不正常的新生蛋白质可能通过细胞毒性等机制破坏蛋白质稳态和细胞内环境[1]。除此之外,新生肽链的质量控制还和衰老及特定的病理条件密切相关。例如,近期的一项工作以秀丽隐杆线虫和酿酒酵母为模型,研究了衰老和蛋白质合成的关系,发现在衰老细胞中核糖体翻译延伸停滞机率的增加,尤其是编码碱性氨基酸簇(K/R,polybasic stretches)的mRNA区域,诱发了核糖体翻译质量控制体系的超载和新生多肽的聚集,从而损害了细胞的蛋白质稳态继而造成类型各异的细胞功能衰退[2]。无论是真核还是原核细胞,都具有一系列的共翻译调控系统,在肽链延伸的同时对新生肽链进行修饰、加工,帮助其实现膜定位及辅助其折叠。RAC(ribosome-associated complex)和NAC(nascent chain-associated complex)是真核生物的两种共翻译折叠系统。研究表明酿酒酵母RAC对新生肽链中的poly-lysine序列的合成具有调控作用,表明RAC在折叠功能之外,可能直接参与核糖体上蛋白质翻译调控。
RAC是由Hsp40和Hsp70组成的稳定异源二聚体,在真核生物中高度保守,其在酵母中对应蛋白为Zuo1和Ssz1。Zuo1的J-domain(JD)结构域能够特异招募酵母的另一个Hsp70蛋白质因子Ssb1/2进入到处于新生肽链合成过程中的核糖体复合物(RNC,ribosome-nascent chain complex),并特异激活Ssb的ATPase活性。ATP水解之后的Ssb-ADP与新生肽链稳定结合直到其完成正确的折叠。遗传数据表明,Zuo1、Ssz1、Ssb三者对于新生肽链的正确折叠缺一不可。RAC系统的结构和功能机制一直是翻译调控领域的一个重要研究内容,迄今为止,该系统的具体分子机制的诸多细节尚不清楚,例如一个Hsp40如何与两个Hsp70配合、Hsp70Ssz1的分子功能、Hsp40Zuo1如何特异招募Hsp70Ssb,新生肽链如何与三个蛋白质组分发生相互作用等等。
2022年6月14日,北京大学生命科学学院高宁课题组于Nature Communications在线发表了题为“Structural remodeling of ribosome associated Hsp40-Hsp70 chaperones during co-translational folding”的研究论文。该研究以酿酒酵母为模型,利用冷冻电镜技术解析了细胞内源的RAC-80S复合物、不同状态的RAC-RNC复合物的十余个高分辨结构,揭示了RAC-Hsp70系统的构象转变,提出了RAC-Ssb的工作机制模型。
首先,结构分析发现,与课题组2014年发表的首个RAC-核糖体低分辨结构[3]一致,Zuo1的N端和C端结构域在空间上分别结合核糖体的大亚基和小亚基。不同的是,在分辨大幅提高的情况下RAC与核糖体的相互作用细节能够被清楚地呈现。RAC结合在核糖体小亚基40S解码中心的rRNA helix 44末端的Zuo14HB结构域使helix 44发生了明显的构象变化,揭示了RAC调控核糖体上的功能中心的结构基础(图1 a)。RAC剩余的部分(Zuo1 NTD)结合在核糖体大亚基60S的肽链通道出口(PTE,peptide exit tunnel),直接和新生肽链发生相互作用。
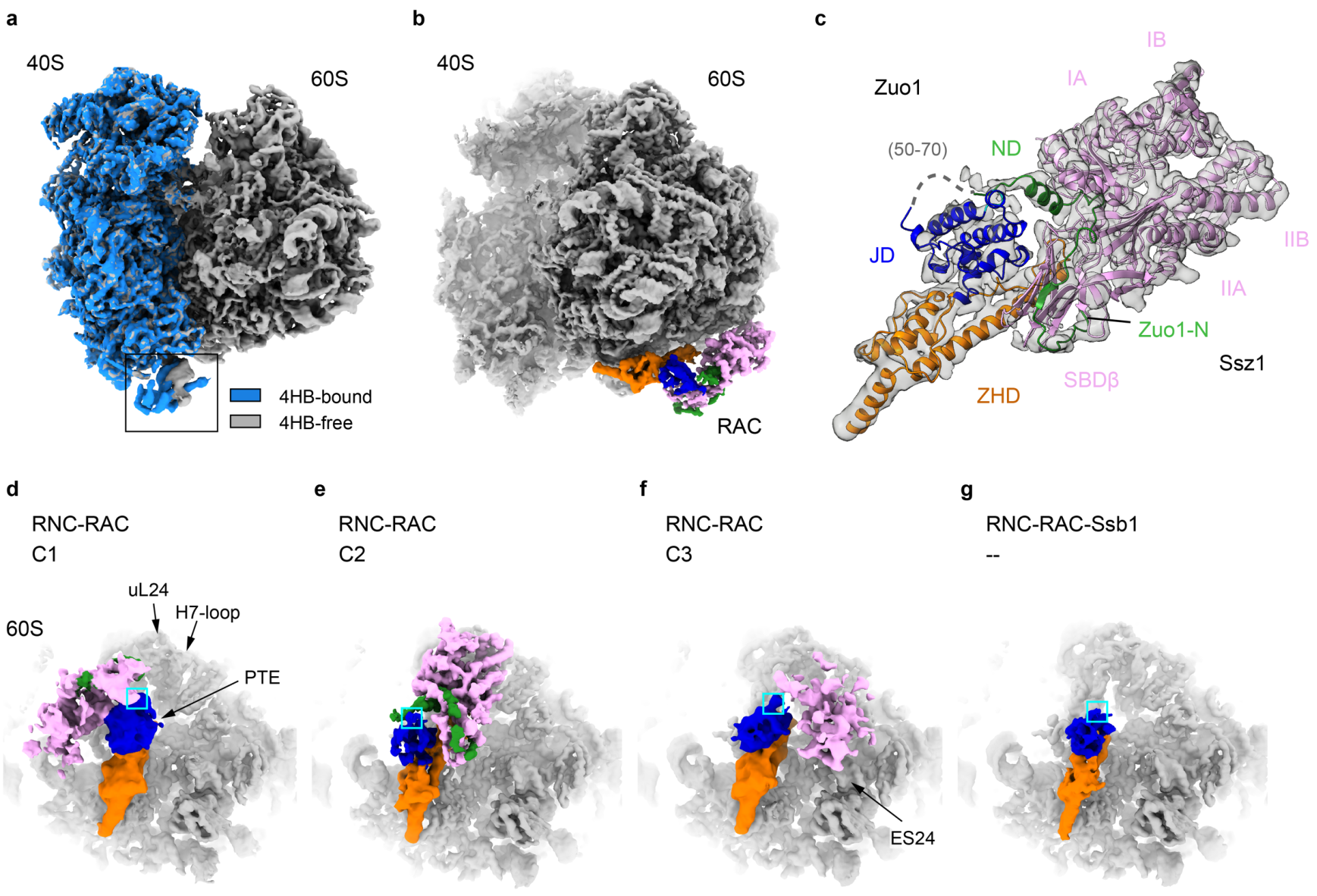
图1. 不同状态的S. cerevisiaeRAC-核糖体复合物冷冻电镜结构
通过针对Zuo1-NTD的局部分类与计算,该研究首次解析了近全长的RAC结构(图1 b-c)。通过解析和对比无新生肽链的RAC-80S复合物、带有新生肽链的RAC-RNC和RAC-RNC(+Ssb1-ATP)复合物的十余个不同状态的结构,该研究发现:(1)在核糖体不进行翻译或新生肽链尚未暴露时,RAC中仅Zuo1与60S相互作用。其中Ssz1远离PTE不与核糖体直接接触,通过对Zuo1 JD形成空间位阻使其不能招募Ssb,处于自抑制状态(图1 d);(2)随着翻译延伸的进行,新生肽链从PTE暴露出来,它首先与Zuo1结合在PTE附近的一小段螺旋结构的疏水表面相互作用,因此Zuo1是RAC-Ssb系统中第一个与新生肽链相互作用的组分;(3)新生肽链的存在还引发了RAC从自抑制状态的构象转变,不同程度地削弱了Ssz1对Zuo1 JD空间阻挡(图1 e-f)。在其中一个较为稳定的构象中,Ssz1进行了大幅度的空间翻转,NBD(nucleotide binding domain)与核糖体相互作用,导致Ssz1罩在PTE正上方,对该空间形成保护之势(图1 e);在Zuo1-Ssz1-PET包围的空间内有一段对应3-4个氨基酸的电子密度,可能是新生肽链,因此Ssz1可能是RAC-Ssb中第二个与新生肽链发生相互作用的组分;(4)而在RAC-RNC中加入Ssb1-ATP后,解析的所有结构中均没有观察到稳定的Ssz1和Ssb1密度(图1 g);传统的Hsp40和其Hsp70搭档的相互作用是瞬时的,因此推测此时的Ssz1和Ssb1都处于高度动态的构象状态。
基于这些新的结构观察以及已有文献报道,该研究提出了RAC-Ssb系统的工作机制模式图(图2)。在这一过程中,不断延伸的新生肽链通过与系统中的不同蛋白质因子发生相互作用,从而引起级联的构象重组过程,使得RAC-Ssb系统能够高效地捕捉新生肽链上的底物序列,从而及时对这些序列进行保护。综上,该研究揭示了新生肽链引发的RAC构象转变的分子基础,阐述了RAC-Ssb系统中3个组成因子在共翻译折叠过程中分工合作的分子机理(图2),对进一步理解共翻译调控和蛋白质折叠机理具有重要意义。
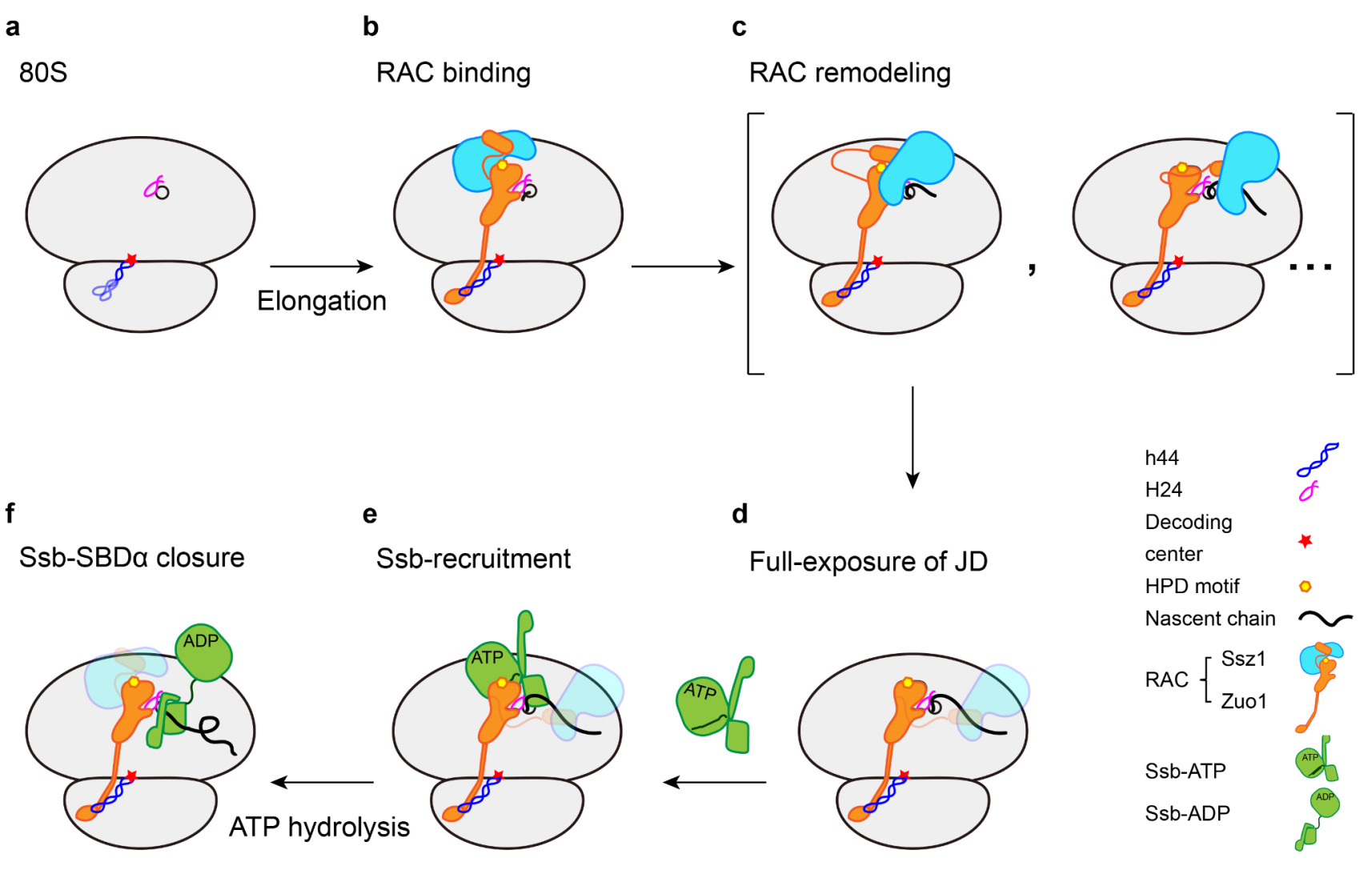
图2. RAC-Ssb共翻译折叠系统的分子机制
高宁教授为该论文的通讯作者,课题组2016级博士生陈燕(已毕业)为本文的第一作者。该研究得到了国家自然科学基金、国家重点研发计划、启东-SLS创新基金、北大-清华生命科学联合中心、膜生物学国家重点实验室的支持。北京大学冷冻电镜平台、电镜实验室、高性能计算平台、生命科学学院仪器中心及凤凰工程等多个仪器平台对本项目提供了重要的技术支撑。
1. Rosenzweig, R., et al., The Hsp70 chaperone network. Nat Rev Mol Cell Biol, 2019. 20(11): p. 665-680.
2. Stein, K.C., et al., Ageing exacerbates ribosome pausing to disrupt cotranslational proteostasis. Nature, 2022. 601(7894): p. 637-642.
3. Zhang, Y., et al., Structural basis for interaction of a cotranslational chaperone with the eukaryotic ribosome. Nat Struct Mol Biol, 2014. 21(12): p. 1042-6.
文章来源北京大学新闻网,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
中欧化工制造商协会 23140

-
张家界运通会务会展有限公司 18351

-
北京东方正通科技有限公司 2410

-
apise 23541

-
香港中文大学 21447

-
美国美中世纪教育集团 21180

-
东南亚研究 23268

-
張家界中國國際旅行社 18265

-
中仿科技有限公司 23304

-
国际工学技术出版协会 23416

-
天津市时光企业策划有限公司 18286

-
北京华斯泰生物医学科技有限公司 2546

-
复旦大学历史系 18252

-
D2ME 24108

-
南山区鹏城实验室 8094

-
深圳市生物医药促进会 2327

-
湖南信息科学职业学院 18276

-
苏州昆山昆山有限公司 21168

-
工程信息研究院 18241

-
上海亚化工程咨询有限公司 2198



















 700
700














































