清华大学生命学院颉伟课题组揭示哺乳动物早期胚胎中染色质高级结构重建与胚胎超转录机制及相互促进关系
2025/09/05
在动物早期胚胎发育中,受精后的父母源基因组会经历一次大规模的三维染色质结构重塑。基因组常见的结构如拓扑相关结构域(topologically associating domains, TADs)和区室(compartments)几乎存在于所有细胞中。但在受精后,TADs和compartments迅速解体,同时染色质呈现出一种高度松弛的状态。这种结构的“擦除”被认为有助于重置基因调控网络,为胚胎发育启动提供新的起点。该过程在目前所有已研究的动物早期胚胎(包括果蝇、爪蟾、斑马鱼、青鳉鱼、小鼠、猪以及人类)中均高度保守。另一方面,染色质高级结构的逐步重建同时伴随着合子基因组激活(zygotic genome activation, ZGA)的发生。然而,对于哺乳动物中这一过程中染色质结构是如何被建立,以及其与生命的第一次基因表达之间的关系,科学界仍知之甚少。
近日,清华大学生命学院颉伟课题组在《自然》(Nature)上发表题为“早期胚胎中染色质高级结构重建与胚胎超转录间的相互作用”(Establishment of chromatin architecture interplays with embryohypertranscription)的研究论文,系统研究了小鼠早期胚胎中染色质高级结构逐步建立过程的调控机制,并揭示了其与一种特殊“超转录”状态之间的双向作用,超活跃的转录活动与染色质高级结构相互促进,共同推动胚胎发育基因程序。
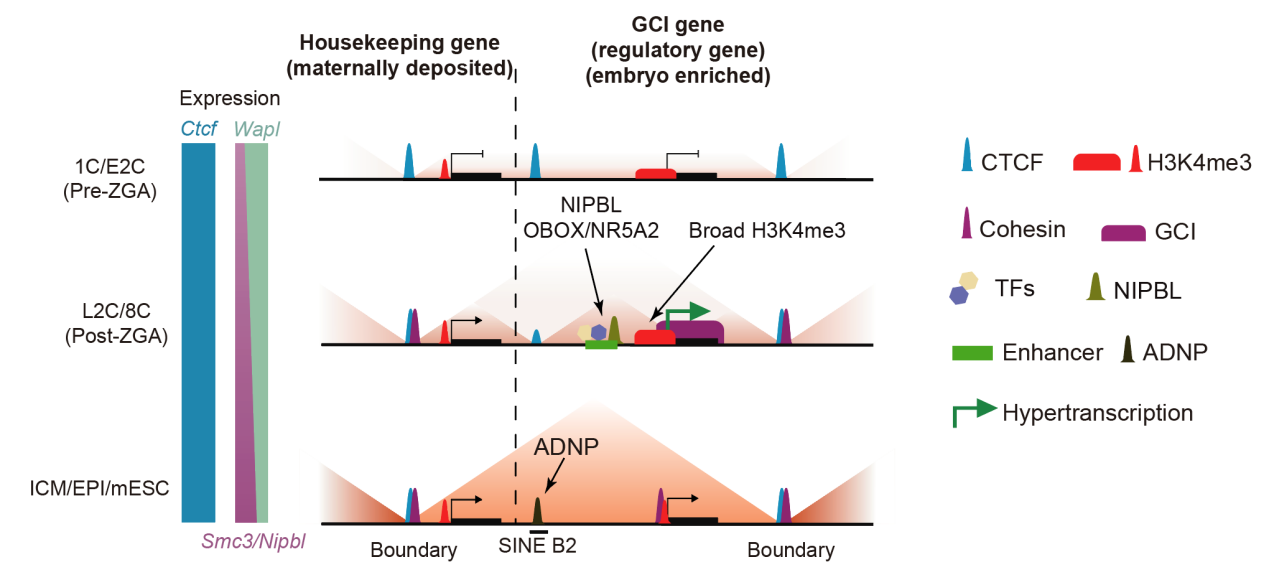
研究首先发现,调控染色质高级结构的关键因子CTCF在整个小鼠早期发育过程中始终稳定结合于基因组。进一步研究发现,除了大多数保守的CTCF结合位点外,CTCF还结合于两类可变区域:一类在1-2细胞期结合较弱,8细胞时期后显著增强,主要分布在启动子区域,且与部分ZGA基因相关;另一类则在1-8细胞期结合较强,但在囊胚内细胞团(inner cell mass,ICM)及后续阶段迅速消失,这类位点多位于SINE B2重复元件上。B2位点上的CTCF结合减少与转录因子ADNP在同一时期的高表达密切相关。ADNP能够与CTCF竞争结合这些B2位点。在ADNP缺失的胚胎中,B2位点的CTCF结合和染色质绝缘性都得以恢复,这些结果揭示了早期胚胎中特定重复序列上CTCF结合及其对染色质高级结构动态调控的机制,与去年高亚威/张勇/高绍荣课题组研究结果一致。
相比CTCF的稳定结合模式,另一种关键结构蛋白——黏连蛋白复合物(cohesin)在1细胞期结合水平极低。这与早期胚胎中cohesin组份及其装载因子NIPBL的低表达,以及卸载因子WAPL的高表达一致。较低的装载效率和较高的卸载效率使得cohesin的环挤压过程的持续性不足。随着发育从2细胞期到8细胞期推进,cohesin及NIPBL的表达增强,WAPL表达下调,cohesin的环挤压能力逐步增强,TAD结构随之逐渐恢复。
小鼠早期胚胎中染色质高级结构的重建与超转录状态间的相互作用
有趣的是,研究团队在2-8细胞期胚胎中的活跃基因上发现了特殊的cohesin富集现象,通常覆盖于整个基因体区域。研究人员将其定义为geniccohesinislands(GCIs)。GCIs是早期胚胎特有的,在ICM和后续阶段的胚胎中迅速消失。进一步研究表明,GCIs与RNA聚合酶II(Pol II)高度共定位。短暂抑制转录延伸会导致GCIs迅速消失,而诱导转录则可在胚胎中产生新的GCIs,表明GCIs的形成依赖于活跃转录。为了探究为何GCIs仅在早期短暂出现,研究人员对Pol II的结合模式和转录活性进行了定量分析,发现2-8细胞期胚胎处于一种显著的“超转录”(hypertranscription)状态,其新激活基因的转录强度比胚胎干细胞分化阶段高6-10倍,比原肠胚形成阶段高2-3倍。这种超转录状态可能是产生早期胚胎特异的GCIs的必要条件之一。
随后的功能分析显示,GCI相关基因更加富集于染色质结构组织、发育调控及细胞命运决定等关键调控类基因类别。这些基因邻近区域富集活跃增强子和胚胎特异转录因子的结合如OBOX、NR5A2、TFAP2C,以及有着更多cohesin装载因子NIPBL的结合,这可能为GCIs的形成提供了大量的cohesin装载位点。已有研究表明,RNA聚合酶可作为障碍(barrier)阻止cohesin在染色质上的滑动,进而影响染色质高级结构2-4。进一步的Hi-C分析发现,GCIs可以作为转录依赖的绝缘元件,与邻近的CTCF位点协同形成类似TAD的相互作用域,且无明显方向偏好性。反过来,cohesin的部分敲降削弱了GCIs的绝缘效应,同时降低了GCI基因表达,最终胚胎停滞于桑椹胚(morula)阶段。最后,研究人员发现GCI基因具有较低的表达噪音,而这种表达的稳定性依赖于cohesin,提示GCIs保障快速发育的胚胎中关键调控基因的稳定高水平表达。
综上,研究揭示了小鼠早期胚胎中染色质高级结构重建与超转录状态间的相互作用:在ZGA之后,胚胎迅速激活特定调控基因,高密度的RNA聚合酶II在基因内部阻滞cohesin的滑动,从而形成GCIs。GCIs反过来与CTCF协同建立高级染色质结构,进而促进胚胎高效而稳定地转录。研究提示,GCIs可能是在TAD尚未完全建立时承担胚胎关键基因特异高效表达的功能。此项工作为理解转录与三维基因组结构之间的耦合关系提供了新的思路。
清华大学生命学院教授颉伟为论文通讯作者,生命学院博士后于广、博士后许锴(已出站)、博士后夏炜焜(已出站)、2016级博士生张珂(已毕业)为论文共同第一作者。
研究得到清华大学实验动物中心的大力协助和支持,同时得到国家自然科学基金、国家科技部重点研发计划、清华-北大生命科学联合中心和中国博士后科学基金的经费支持。
文章来源清华大学,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
北京贝拓会展 18308

-
北京路川国际展览有限公司 2251

-
华圣智远 24321

-
江南大学食品学院 8437

-
济南兆龙文化传媒有限公司 2244

-
上海华宏MBA培训中心 18341

-
浙江大学 8523

-
陕西博瑞克会议策划有限公司 23210

-
东北师范大学城市与环境科学学院 21522

-
中国稀土学会 23173

-
上海仪诺展览服务有限公司 24242

-
中国科学院科学时报 2199

-
EAGWA 8623

-
洛阳有色金属加工设计研究院 24400

-
CD 24232

-
烟台惠通网络技术有限公司 2180

-
北京全卫联合医学科学研究院 2305

-
CSADC2017 23358

-
个人 24264

-
同济大学 21249



















 187
187