北京大学生命科学学院肖俊宇研究组揭示FcRL5受体识别IgG的分子机制
2026/01/08
免疫球蛋白,也称为抗体,是体液免疫反应的核心组成部分。人体中免疫球蛋白可分为5类:IgM、IgD、IgG、IgE和IgA。在先前的研究中,北京大学生命科学学院肖俊宇研究组对IgM、IgA和IgE的分子机制进行了深入研究,阐明了它们的组装机制及其与受体或病原体蛋白的相互作用机制,为理解这些抗体的功能提供了新的视角[1—6]。
IgG是人类血清中含量最高的抗体,其Fc区域能够与多种效应分子相互作用,包括FcγR、C1q、FcRn和TRIM21,从而介导吞噬作用、细胞毒性、转胞吞作用、延长抗体半衰期,以及通过蛋白酶体清除被抗体包被的病原体等多种功能[7]。深入理解IgG-Fc与这些效应分子的作用机制,为治疗性抗体的设计与优化提供了重要依据[8]。
FcRL5(也称FcRH5或IRTA2)属于Fc受体样家族(Fc receptor-like family),与经典FcγR具有结构同源性[9]。FcRL5是该家族中最大的成员,包含9个Ig样结构域(D1—D9)、跨膜区以及同时具备活化与抑制基序的胞内结构。FcRL5仅在B细胞上表达,在初始B细胞、记忆B细胞和浆细胞中最为丰富,并作为BCR的共受体对B细胞功能发挥双向调节作用[10—12]。此外,FcRL5在多种B细胞恶性肿瘤中高表达,目前有多种以FcRL5为靶点的多发性骨髓瘤治疗策略正在研发中[13—15]。FcRL5被认为可以通过其前三个Ig样结构域(D1—D3)结合热聚集的IgG[16],但其在生理条件下是否是真正的IgG受体,以及其识别IgG的具体分子机制仍不清楚。
2026年1月2日,肖俊宇研究组在Science Advances期刊发表题为“Human FcRL5 is an Fc receptor that simultaneously engages two IgGs”的研究论文,揭示人源FcRL5以一种依赖于亲合力(avidity)的独特方式识别IgG,同时结合两分子IgG为其受体功能及生物学意义提供了重要的分子基础。
鉴于之前报道FcRL5能结合热聚集的IgG,研究团队首先考虑热聚集的IgG是否反映了IgG多聚体。已知IgG在结合高密度膜抗原后可发生天然六聚体化,这一过程对补体依赖的细胞毒性(complement-dependent cytotoxicity,CDC)至关重要。之前,肖俊宇研究组从非洲爪蟾中的IgX抗体得到了启发,开发了一种适用于构建人源IgM和IgG六聚体的策略[17]。基于这一思路,研究团队制备了IgG1-Fc六聚体并开展pull-down实验。结果显示,FcRL5对六聚体化的IgG1-Fc具有显著结合能力,而对单体形式的结合则并不明显。相比之下,经典FcγR(如FcγRIIA、FcγRIIB和FcγRIIIA)在相同条件下均能有效结合IgG1-Fc单体,体现出两类受体在识别机制上的本质差异。进一步实验表明,小鼠FcRL5不与小鼠IgG-Fc六聚体结合,因此不应被视为人源FcRL5的功能对应物。
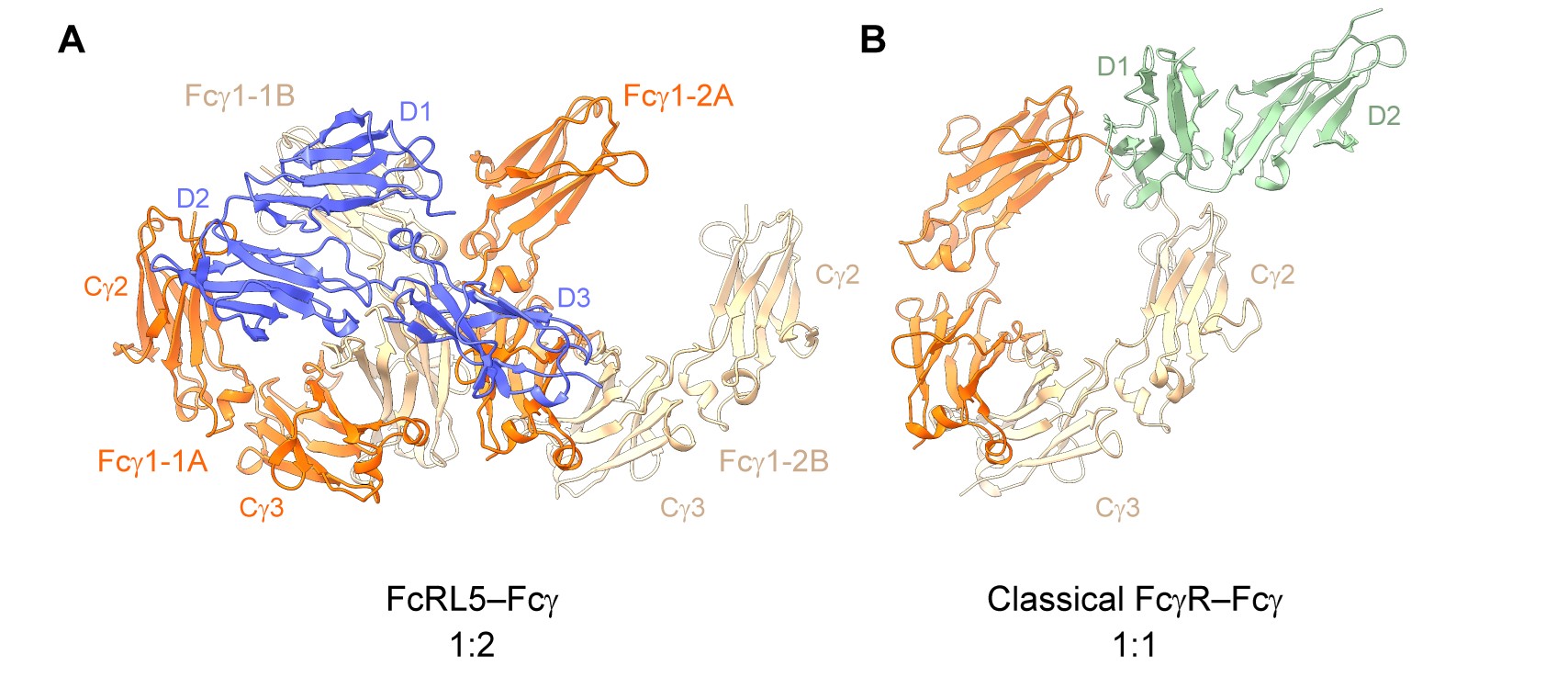
图1. FcRL5–IgG-Fc和经典FcγR–IgG-Fc的结合模式比较
研究团队利用冷冻电镜解析了FcRL5和IgG1-Fc复合物的结构(图1A)。结果显示,FcRL5的D1—D3结构域同时与两个Fc分子发生作用:D1—D2结构域结合第一个Fc分子,而D3结构域结合第二个Fc分子。也就是说,只有当两个Fc分子在空间上足够接近时才能与FcRL5形成稳定而高亲和力的结合。这一“1:2”双配体识别模式与经典FcγR的“1:1”识别模式截然不同,体现出FcRL5独特的受体特性(图1)。
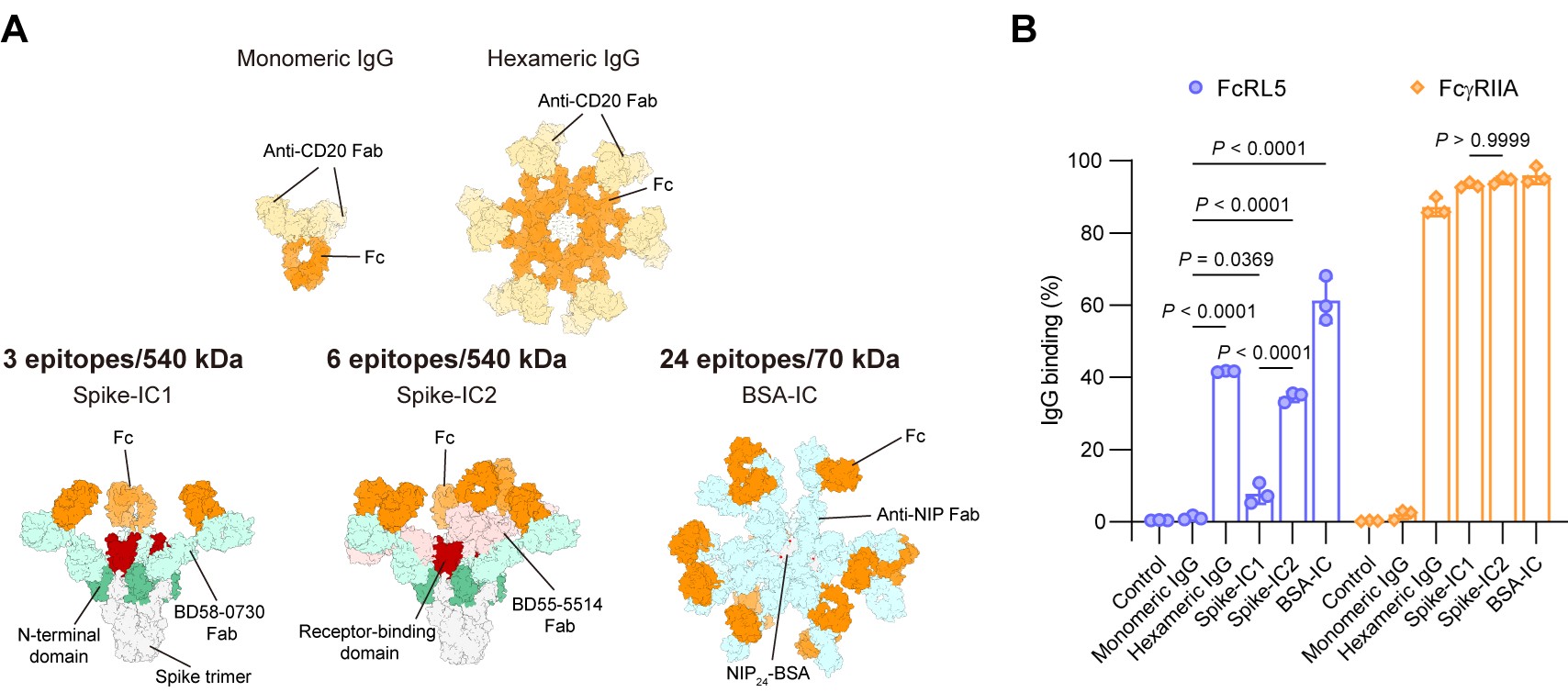
图2. FcRL5“感知”免疫复合物中IgG的密度
研究团队进一步推测,在由多抗原和多抗体构成的免疫复合物(immune complexes,ICs)中,一些IgG-Fc同样会因空间接近而满足FcRL5的识别需求。为此,研究者构建了3种IgG免疫复合物(图2A),并根据抗原表位数量与分子量的比值,推断免疫复合物中IgG的密度排序为:Spike-IC1<Spike-IC2<BSA-IC。经检测,3种免疫复合物与细胞表面FcRL5的结合强度与IgG密度呈明显正相关,即Spike-IC1结合最弱,Spike-IC2显著增强,而BSA-IC显示最强信号(图2B)。相比之下,经典受体FcγRIIA则能与所有多价IgG复合物强力结合。这些结果说明,经典FcγR与多价IgG复合物的结合仅取决于单价亲和力和IgG分子的数量,而FcRL5的结合还受到IgG-Fc的局部密度与空间排列的影响。正是这种独特的结合模式赋予了FcRL5“感知”免疫复合物中IgG密度的能力。进一步实验显示,FcRL5与不同IgG亚类所构成的免疫复合物均能结合。此外,共聚焦分析表明FcRL5能介导IgG免疫复合物的内化,并将其运送至溶酶体。
总结而言,这项研究明确定义了人源FcRL5是一个真正的IgG-Fc受体,揭示了一种依赖“亲合力”的独特识别模式。这一机制不仅拓展了我们对B细胞信号调控的理解,也为治疗性IgG抗体的设计与优化提供了新的思路与方向。
北京大学前沿交叉学科研究院2020级博士研究生陈诗婳(PTN项目)、北京大学生命科学学院2023级博士研究生李姝涵和已毕业博士张志莹(PTN项目)为该论文的共同第一作者,肖俊宇为该论文的通讯作者。该研究得到了国家自然科学基金委、国家重点研发计划、北京大学生命科学学院启东产业创新基金、北京大学成都前沿交叉生物技术研究院创新基金的资助。北京大学冷冻电镜平台、昌平实验室冷冻电镜平台、北京大学生命科学学院仪器中心为该研究提供了重要支持。
文章来源北京大学,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026资源、化学化工与应用材料国际 218

-
2026年智能制造与光学传感技术国际 235

-
2026年2月高录用率国际学术会议列 37

-
2026年第六届土木工程与建筑国际会 841

-
2026年图像处理与数字创意设计国际 90

-
2026年机械工程,新能源与电气技术 4589

-
2026年材料科学、低碳技术与动力工 307

-
2026年第二届无线与光通信国际会议 1149

-
2026 9th Internati 01-15

-
2026年土木工程智能建造与基础设施 01-15

-
2026年环境工程、生态修复与可持续 01-15

-
2026年数字健康、远程医疗与智能诊 01-15

-
2026年金融科技、智能风控与数字资 01-15

-
2026年智慧农业、食品工程与供应链 01-15

-
2026年计算建模、数学与大数据国际 01-15

-
2025年两院院士增选有效候选人2854

-
2025最新JCR分区及影响因子7970

-
好学术:科研网址导航|学术头条分3741

-
2025年国际期刊预警名单发布!3763

-
2025年中科院期刊分区表重磅发13927

-
中国科协《重要学术会议目录(208283

-
吉林大学校长张希:学术会议中的提4800

-
清华大学物理系徐勇、段文晖研究组12-25

-
清华大学-上汽通用五菱汽车人工智12-25

-
参加学术会议学术蝗虫_参加学术会12-25

-
参加学术会议图片_参加学术会议需12-25

-
参加学术会议投稿邮件_参加学术会12-25

-
参加学术会议文学_参加学术会议有12-25

-
参加学术会议文案_参加学术会议文12-25

-
参加学术会议违法_参加学术会议违12-25

-
河北工业大学 21819

-
上海第二工业大学 2145

-
重庆理工大学 8350

-
北京格瑞纳电子产品有限公司 24329

-
北京艾尚国际展览有限公司 8405

-
同济大学 21332

-
第二届新型材料与化学工业国际学术 24112

-
The 4th Internat 24242

-
中国林业科学研究院热带林业研究所 23276

-
上海赛诺瑞会展有限公司 8264

-
西安科技大学 23391

-
北京国际交流协会 23507

-
上海市粘接技术协会 23481

-
巨成科技 8500

-
中国科学技术大学 24330

-
武汉高流明投影机租赁公司 2183

-
成都鼎坚展览服务有限公司 18286

-
广州国际大健康博览会高峰论坛 21141

-
中国水利技术信息中心 2161

-
个人 24218



















 43
43