清华大学生命学院吝易实验室合作揭示脂肪细胞内质网中错误折叠的蛋白处理新机制
2024/04/10
细胞通过各种不同的蛋白质量控制机制(Protein Quality Control Mechanisms)防止有害蛋白聚集。 这些蛋白质量控制机制的退化或故障导致众多人类疾病,如糖尿病、癌症,以及各种老年疾病等。内质网作为蛋白质折叠和质量控制的主要场所,利用内质网蛋白降解(ERAD)和内质网自噬(ER-phagy)两种机制降解错误蛋白。其中ERAD有针对性地降解内质网中的蛋白,而ER-phagy,作为自噬(autophagy)的一种,常被认为批量降解已碎片化的内质网或内质网域(ER fragments/domains)。然而,作为两种最重要的蛋白降解机制,人们对ERAD和ER-phagy的作用机制,尤其是在生理条件下二者如何协同并维护内质网稳态仍知之甚少。
5月31日, 密歇根大学医学院齐岭教授课题组及清华大学生命科学院、清华-IDG/麦戈文脑科学研究院吝易助理教授课题组在《自然·通讯》(Nature Communications)期刊上在线发表题为“脂肪细胞中内质网处理错误折叠蛋白机制”(The mechanisms to dispose of misfolded proteins in the endoplasmic reticulum of adipocytes)的研究论文。研究揭示了在小鼠脂肪细胞中SEL1L-HRD1 ERAD和ER-phagy的共同作用机制,并发现脂肪细胞对错误折叠蛋白在内质网中的积累可能具有高度适应性。正常状态下ER-phagy功能受到限制,SEL1L-HRD1 ERAD为降解错误折叠蛋白核心机制。当SEL1L-HRD1 ERAD功能下降时,脂肪细胞中ER-phagy功能增加,从而减少错误折叠蛋白形成的聚集物在内质网中积累。而在SEL1L-HRD1 ERAD和ER-phagy功能均下降的情况下,错误折叠的蛋白可以被储存在一种由内质网碎片聚集融合形成的特殊细胞结构中。这种细胞结构被命名为Coalescence of ER Fragments(CERFs)。研究者推测此种结构可能对脂肪细胞(至少在短期内)适应蛋白质量控制机制缺陷具有重要作用。
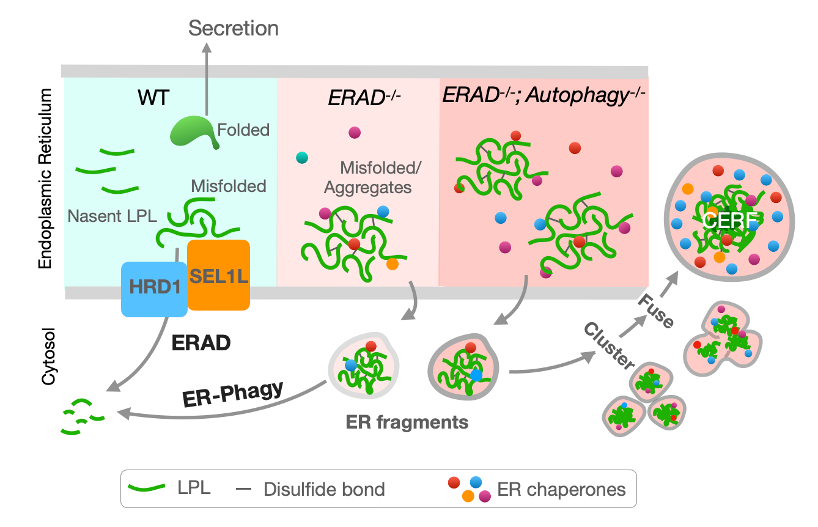
图1. 小鼠脂肪细胞有步骤地处理内质网中错误折叠蛋白及蛋白高聚物的假设模型

图2. 透射电子显微镜(TEM)下观察到在脂肪细胞特异SEL1L-HRD ERAD和ER-phagy双敲除(DKO)的小鼠的脂肪组织里形成的CERFs结构(a,箭头:在CERFs中的类膜结构)。使用免疫金染色后,在TEM下观察到CERFs结构(绿色虚线)富集着内质网腔标记蛋白BiP(b)。
随后,研究者利用免疫沉淀质谱法(immunoprecipitation-mass spectrometry)分析了小鼠脂肪组织中CERFs的主要成分。结合一系列生化分析,他们发现脂蛋白脂肪水解酶- lipoprotein lipase(LPL)是CERFs主要的蛋白成分,也是脂肪细胞中重要的ERAD底物。
LPL主要由脂肪与肌肉细胞分泌,其主要功能是水解在乳糜微粒(Chylomicrons)和极低密度脂蛋白(VLDL)里的甘油三酯。LPL的功能缺失在严重的情况下可以导致I型高脂蛋白血症,而较轻程度上则引起体内脂蛋白代谢的紊乱。因此,阐明LPL蛋白在细胞内的合成机制将为了解、预防或治疗高血脂疾病作出重要贡献。
研究发现,LPL在内质网中的折叠主要受SEL1L-HRD1 ERAD控制。ERAD可及时清除在内质网中错误折叠的LPL蛋白,从而确保正确折叠的LPL蛋白被正常分泌。在ERAD功能缺失情况下,LPL会形成蛋白高聚物;然而,此时脂肪细胞可激活ER-phagy作为ERAD缺失的补偿机制,限制LPL在内质网中聚集。若脂肪细胞中ERAD和ER-phagy功能双重缺失,错误折叠LPL蛋白将被储存在CERFs,并随着时间形成低溶解度的高聚物。
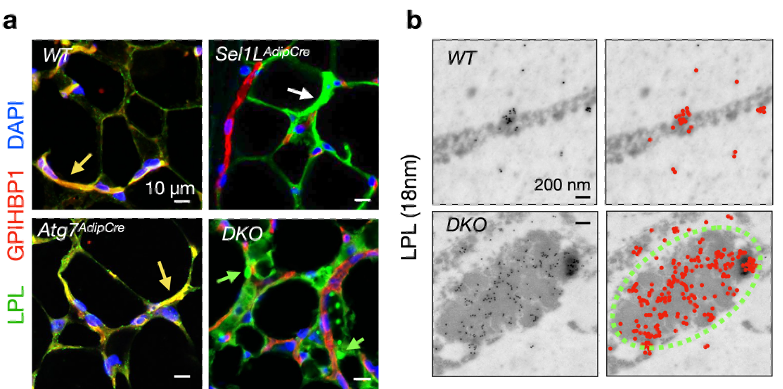
图3. 使用免疫荧光实验在共聚焦显微镜下观察到,在野生型(WT)和自噬单敲(Atg7AdipCre)的小鼠中,LPL可被脂肪细胞分泌并进入血管中,从而与血管标记蛋白GPIHBP1共定位(a,黄色箭头);然而在SEL1L-HRD1 ERAD单敲(Sel1LAdipCre)和ERAD与自噬双敲(DKO)的小鼠中, LPL累积在脂肪细胞中从而不能被正常分泌到血管中(a,白色箭头)。相比于SEL1L-HRD1 ERAD单敲(Sel1LAdipCre),在双敲小鼠(DKO)中,LPL不仅在脂肪细胞中累积,大部分且形成圆形焦点(a,绿色箭头)。使用免疫金染色特异标记LPL后,可在TEM下观察到LPL在双敲脂肪细胞中富集于CERFs结构(绿色虚线)中(b)
研究还发现了CERFs中蛋白的特异分布形态。荧光和免疫金电镜成像结果均显示在CERFs中,LPL被内质网中的分子伴侣BiP包裹。为了验证CERFs组装的机制,研究者对CERFs进行了体外重构。结果显示,纯化的LPL蛋白具有自聚集的能力,能够在体外自发相分离并形成中空的具有类似胶状性质的液滴。另外,纯化的BiP可与LPL一起相分离并在体外形成BiP包裹LPL的液滴。这些发现将为未来进一步阐明LPL在细胞内的聚集和调控机制打下基础。
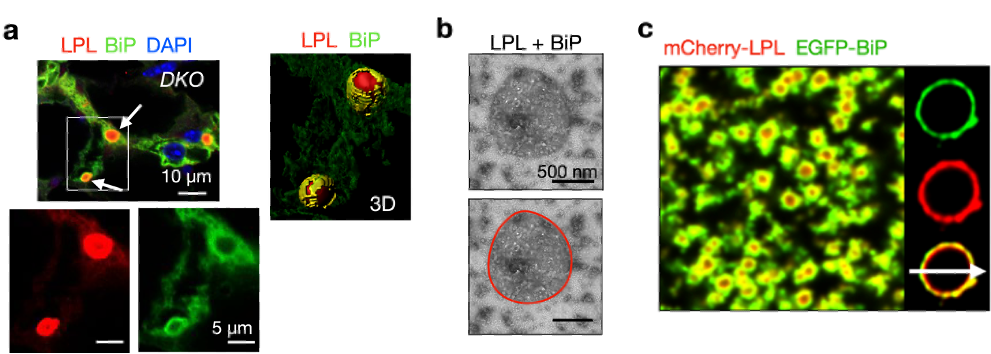
图4. 使用免疫荧光实验在共聚焦显微镜下观察到,在ERAD与自噬双敲的小鼠(DKO)脂肪组织中,LPL CERFs的外围被BiP环绕(a,箭头)。负染色后,在TEM下观察到纯化BiP与LPL一起相分离(b)。荧光染色后,发现纯化的BiP包裹LPL液滴(c)
综上,本研究利用小鼠模型首次证实了SEL1L-HRD1ERAD和ER-phagy在生理条件下的互作。二者共同控制重要生理功能蛋白的折叠与降解,从而维持内质网与细胞稳态。 同时,研究者首次发现脂肪细胞中由内质网碎片聚集融合形成的特殊细胞结构CERFs,揭示了其生理功能,并解析了CERFs的主要蛋白成分及组装机制。未来研究将进一步探究 ERAD,ER-phagy和CERFs形成在由蛋白折叠缺陷引起的疾病中的重要性。
密歇根大学医学院齐岭教授,清华大学生命科学院、清华-IDG/麦戈文脑科学研究院吝易助理教授为本文共同通讯作者。密歇根大学博士生吴霜程(Alivia)为第一作者。清华大学生命科学院申晨晨进行了体外试验部分。其他密歇根大学医学院齐岭实验室科研同事协助实验。
文章来源清华大学新闻,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
北京市红百合 18254

-
内蒙古工业大学 24421

-
南方工艺有限公司 23177

-
济南大学绿色发展研究院 23506

-
武汉科之梦会务服务有限责任公司 8300

-
北京中材企联新材料技术研究中心 21154

-
德捷会晤服务有限公司 18501

-
广东省医学会 21459

-
北京齐鸣经纪文化发展公司 18164

-
上海市护理学会 2420

-
津安商务(天津)旅游会议有限公司 23340

-
深圳市安视佳电子监控摄像机厂家 18276

-
中国中医科学院广安门医院肿瘤研究 18264

-
APC 23517

-
亚洲理工学院 2388

-
南京财经大学 23319

-
湖南科技大学 21236

-
上海麦峰医学科技有限公司 8929

-
云南广大科技开发中心 2165

-
GRSGRE 8440



















 677
677














































