清华大学生物医学工程学院刘鹏课题组合作开发可模拟系统性抗肿瘤免疫的肺癌类器官共培养模型
2025/06/20
肺癌是全球发病率和致死率最高的恶性肿瘤之一。近年来,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)显著改善了部分晚期肺癌患者的预后,但总体的患者客观缓解率仍有待提高。当前大多数类器官免疫模型由于缺乏外周免疫系统成分,难以全面模拟肿瘤细胞与系统免疫细胞之间的相互作用。同时,现有类器官共培养模型在促进肿瘤类器官与免疫细胞有效互作方面仍存在显著局限。因此,亟需开发一种能够增强二者互作效率的体外模型,从而更真实地重现患者体内的肿瘤免疫响应进程。
6月12日,清华大学生物医学工程学院副教授刘鹏课题组在《细胞·干细胞》(Cell Stem Cell)发表题为“可模拟系统性抗肿瘤免疫的肺癌类器官共培养模型”(An organoid co-culture model for probing systemic anti-tumor immunity in lung cancer)的研究论文。该研究建立了一种临床来源的肿瘤类器官“胶-液界面式”(Gel-liquid interface,GLI)共培养免疫模型,可有效模拟肺癌患者体内局部肿瘤微环境与外周免疫系统之间的互作。
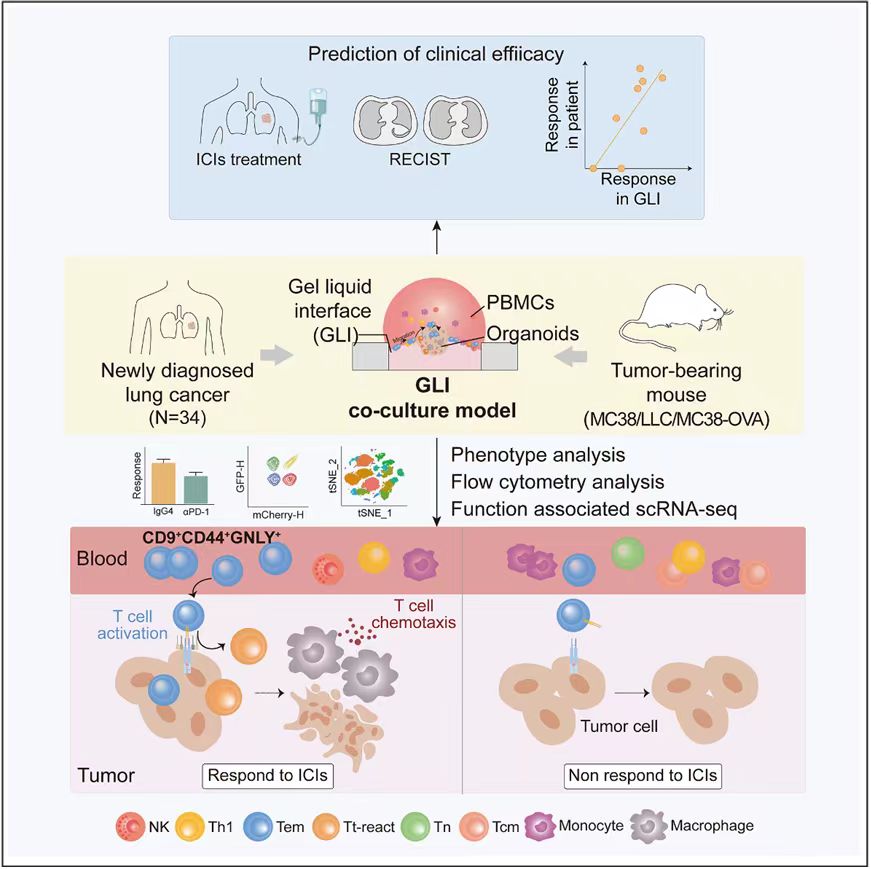
本研究围绕GLI共培养模型,系统开展了临床应用探索与免疫进程解析的多层次研究(图1)。研究构建了基于患者肺癌类器官(Lung cancer organoids,LCOs)及其外周血单核细胞(Peripheral blood mononuclear cells,PBMCs)的GLI共培养体系,有效增强了类器官与外周免疫细胞之间的互作效率。
图1.GLI类器官共培养模型解析肺癌系统性抗肿瘤免疫进程
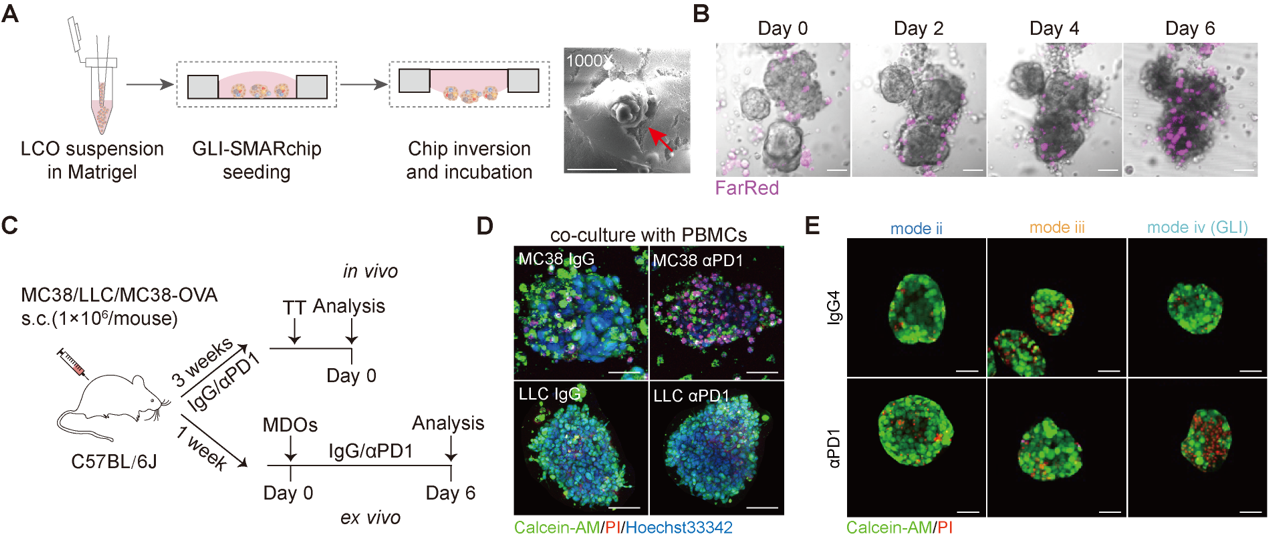
本研究设计了一种胶-液界面式超疏水微阵列芯片(Gel-liquid interface superhydrophobic microwell array chip,GLI-SMARchip),在1.5μL的液滴单元内构建LCOs与PBMCs的共培养体系。该模型使肿瘤类器官聚集于基质胶层表面,而PBMCs悬浮于上层培养基中,从而在胶-液界面形成稳定的空间接触,有效促进类器官与免疫细胞间的接触作用,从而模拟局部TME与系统性免疫细胞之间的协同关系。基于该策略所构建的小鼠及肺癌患者体外模型均呈现了良好的免疫细胞浸润与肿瘤免疫反应进程(图2)。
图2.不同种属的GLI类器官共培养模型的构建与验证
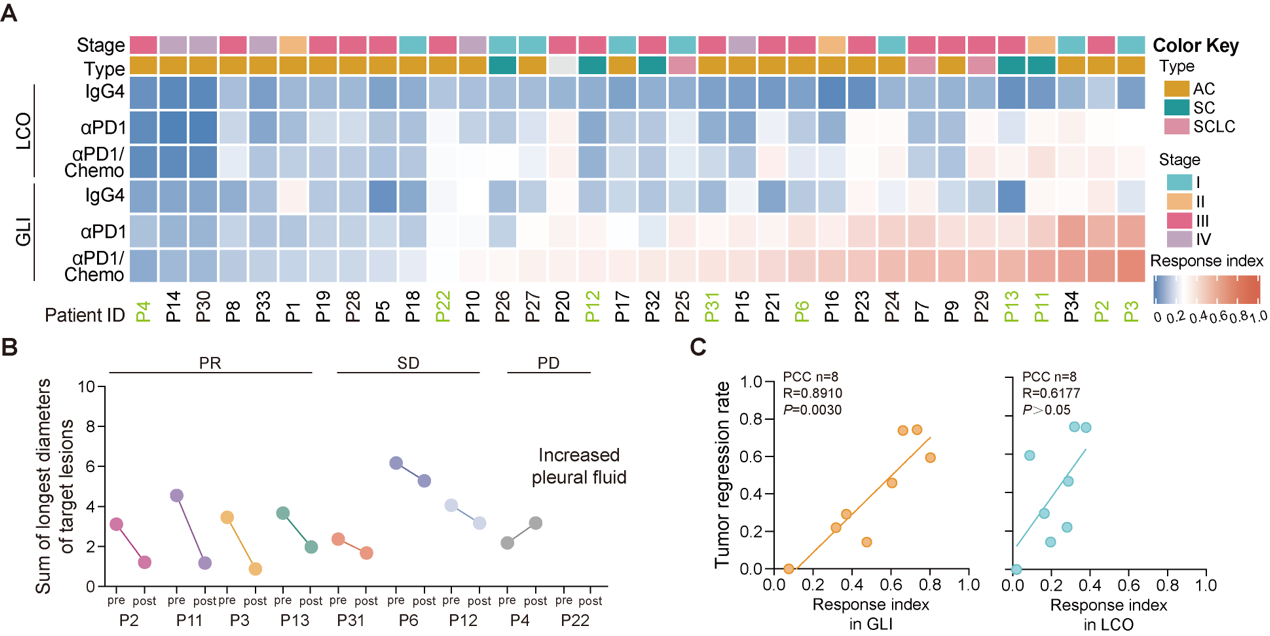
研究共建立了34例肺癌患者来源的GLI共培养模型,涵盖腺癌、鳞癌及小细胞肺癌亚型。通过评估免疫治疗(PD-1单抗或联合化疗)后的响应指数(Responseindex,Ri),发现Ri与患者实际临床疗效高度一致(R=0.89)。尤其在9例接受真实免疫治疗的患者中,GLI模型可准确区分临床部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)人群。相比之下,缺乏PBMCs的类器官单培养模型(LCO)未能有效预测疗效,提示系统性肿瘤免疫的模拟对于准确反映临床免疫疗效至关重要(图3)。
图3.GLI类器官共培养模型的免疫药敏响应可反映肺癌临床免疫疗效
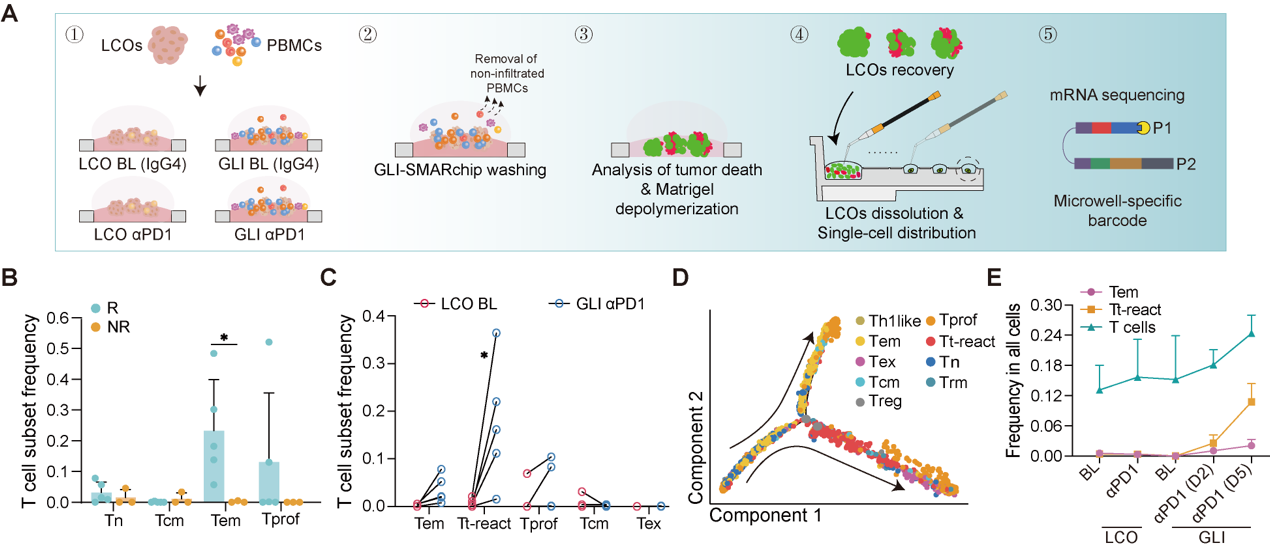
通过对共培养模型开展功能性单细胞转录组测序,可发现αPD1治疗响应组患者的PBMCs中存在更高比例的效应记忆T细胞(Tem)。而拟时序与真实时间线组别相结合的分析共同表明,Tem在与LCOs共培养接触的过程中逐渐转变为了具有更高细胞毒性和激活特征的肿瘤反应性T细胞(Tt-react),从而促成了更为显著的免疫治疗响应(图4)。
图4.PBMCs中的效应记忆T细胞具有肿瘤反应性潜能
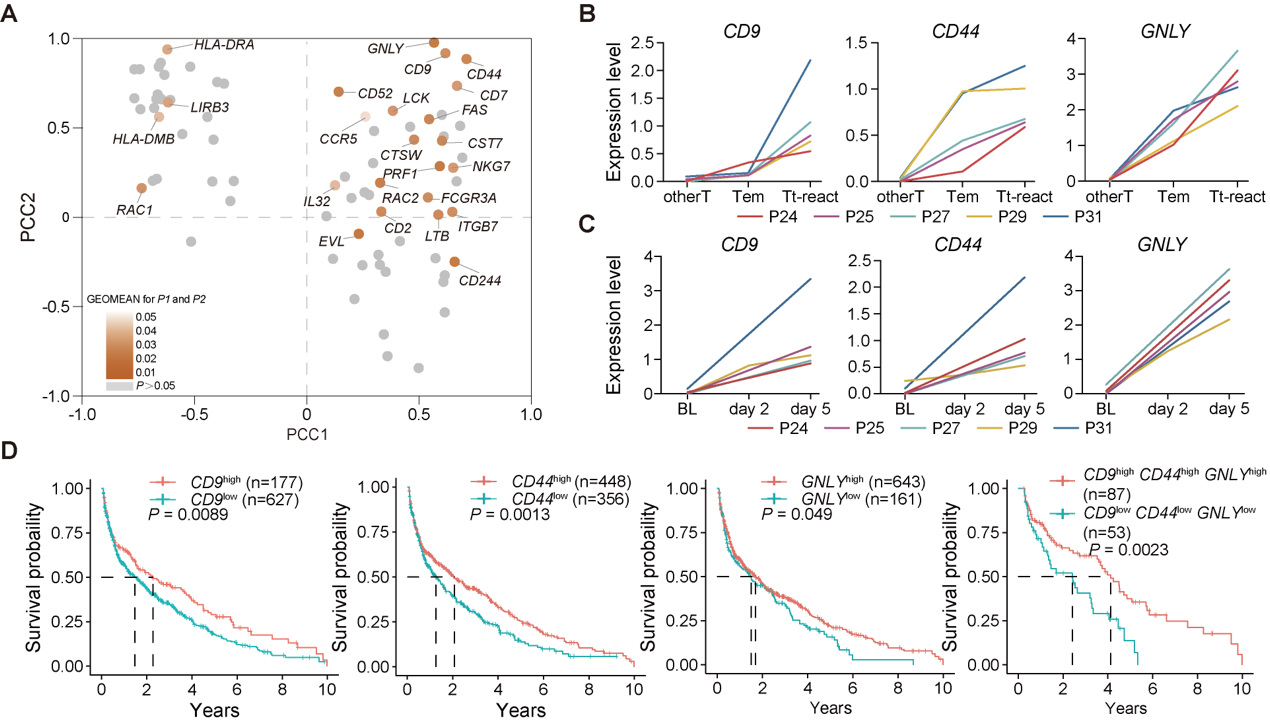
通过将肿瘤杀伤表型与单细胞转录组数据进行整合分析,研究鉴定出GNLY、CD44和CD9三基因在Tt-react群体中持续高表达,且与αPD1治疗响应显著相关。这三种标志物不仅在多例肺癌患者样本中得到验证,亦在TCGA肺癌队列中与患者总生存期(OS)呈正相关(图5),显示出潜在的临床预测价值。
图5.CD9、CD44与GNLY可共同表征外周血中具备肿瘤反应性潜力的T细胞
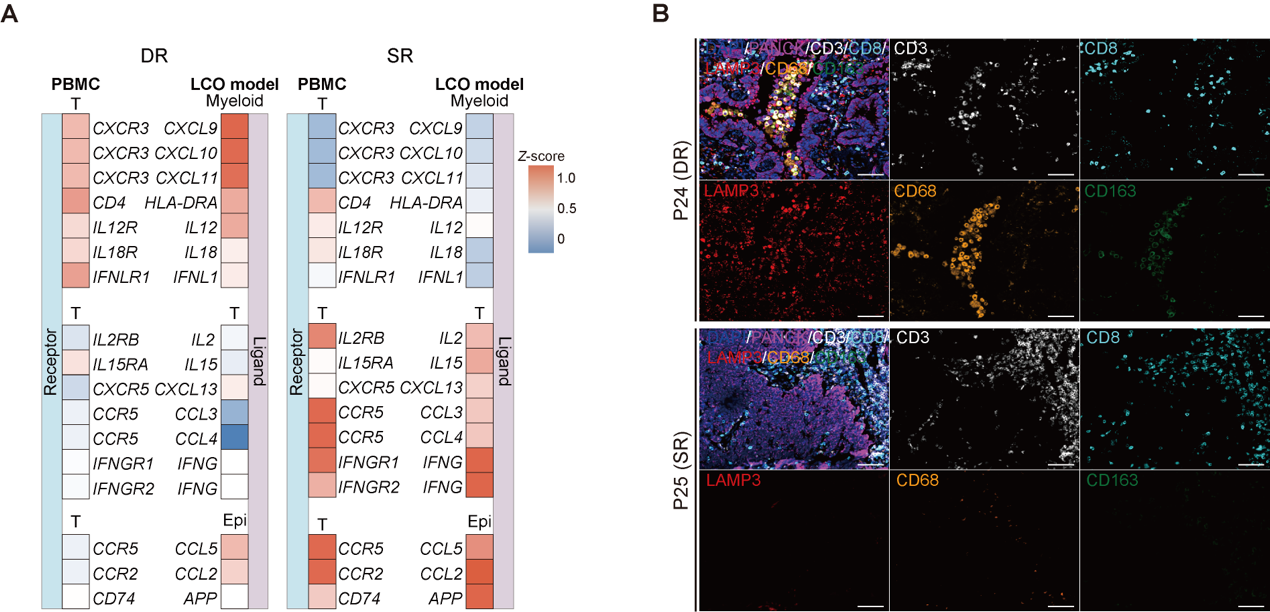
进一步归纳不同患者模型的免疫响应模式,研究发现对αPD1治疗存在“双响应”(即LCO与GLI模型皆存在响应)的患者中,其PBMCs具备更高比例的干性与增殖特征的T细胞亚群(Tprof),且其类器官微环境中富集了促进T细胞募集的巨噬细胞和树突状细胞亚型;而在“单响应”(仅GLI共培养模型存在响应)的患者中,则主要依靠部分上皮细胞对T细胞的趋化作用,以及进一步的T细胞内部正反馈激活与招募效应。这一现象进一步表明,肺癌患者对免疫治疗的响应结果是由肿瘤微环境与外周免疫状态共同决定的(图6)。
图6.具有不同免疫响应模式的患者模型中存在的外周血T细胞与肿瘤微环境异质性
综上所述,本研究所构建的GLI类器官-免疫细胞共培养模型,首次在体外重构了肺癌患者系统性肿瘤免疫成分并模拟了相应的肿瘤免疫响应进程,突破了传统模型在系统免疫评估方面的局限。
清华大学生物医学工程学院副教授刘鹏、北京航空航天大学生物医学工程学院副教授陈晓芳、北京大学人民医院胸外科主任医师杨帆为论文通讯作者。清华大学生物医学工程学院李恺怡博士、刘畅博士,北京大学人民医院主任医师隋锡朝为论文共同第一作者。研究得到国家自然科学基金重点项目等的支持。
文章来源清华大学,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
武汉科研文化发展有限公司 23245

-
瑞士西北应用科学大学 2236

-
河南华宸置业有限公司 18130

-
上海振贸会展有限公司 8185

-
河湖生态大会组委会 23353

-
蚌埠市会展中心 24383

-
北京联合大学信息学院 23258

-
励德爱思唯尔信息技术(北京)有限 23381

-
北京多维路桥 18622

-
中国工程物理研究院 21346

-
东北电力大学科研处 21212

-
武汉布洛克斯玛热交换器公司 21198

-
中国民营科技促进会离子技术专业专 23431

-
重庆工商大学 23193

-
应用力学,机电一体化及智能化系统 21200

-
首都经济贸易大学 23411

-
西北工业大学 21386

-
上海大学 23267

-
沈阳大学沈阳大学 21288

-
IETP-Association 24179



















 370
370