北京大学生命科学学院高宁课题组解析人源SPATA5复合物参与核糖体大亚基组装的分子机制
2025/05/17
核糖体是细胞内负责蛋白质合成的分子机器,其生物生成过程异常复杂且能量消耗巨大。核糖体蛋白或者组装因子的遗传突变会引起组装以及功能的异常,产生一系列疾病表型,即核糖体病(Ribosomopath)1。核糖体组装过程中的多个关键步骤需依赖AAA+ATPase家族蛋白的能量驱动。在酵母中,AAA+ATPase Drg1负责在细胞质中解离早期组装因子Rlp24,以实现组装因子Rlp24与核糖体蛋白Rpl24的更换。Drg1的人源同源蛋白SPATA5近年来被发现与多种遗传疾病密切相关,相关突变会导致智力障碍、听力丧失、癫痫等临床表型2。然而,人源SPATA5是否承担类似Drg1的分子功能,以及其具体的工作机制仍不清楚。
2025年4月23日,北京大学生命科学学院高宁教授课题组在Nature Communications在线发表题为“Cryo-EM structure of the AAA+SPATA5 complex and its role in human cytoplasmic pre-60S maturation”的研究论文。该研究解析了人源SPATA5四元复合物(SPATA5-SPATA5L1-CINP-C1orf109)的高分辨率冷冻电镜结构,并进一步捕获了该复合物被招募到pre-60S核糖体的结构状态,揭示了其在组装因子RLP24解离中的关键作用以及高等生物这一过程的种属特异性特征。
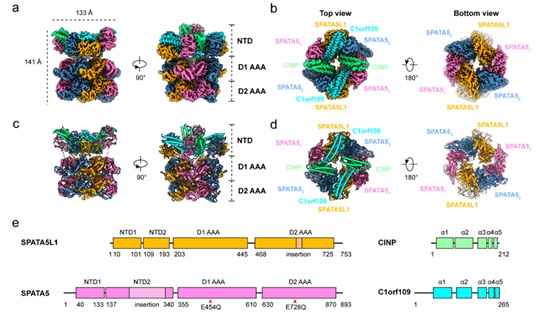
SPATA5(Spermatogenesis-associated protein 5)在精子发生的早期阶段表达显著,提示其可能在精子生成过程中发挥重要作用。功能研究表明,SPATA5蛋白的敲低会干扰小鼠神经元中线粒体的动态平衡,具体表现为线粒体融合与分裂比例的异常,且多项研究进一步支持SPATA5的功能与线粒体稳态密切相关。本研究首先证实了在人类细胞中SPATA5与其旁系同源蛋白SPATA5L1以及C1orf109和CINP组成的稳定的SPATA5复合物,并通过单颗粒冷冻电镜技术,解析了该复合物的高分辨率三维结构。SPATA5复合物由SPATA5、SPATA5L1、CINP和C1orf109以4:2:2:2的比例组装而成,其中SPATA5/L1的ATPase结构域形成独特的异源六聚体,SPATA5/L1的N端则与两个C1orf109-CINP异源二聚体形成独特的NTD环。
图1 SPATA5复合物整体结构
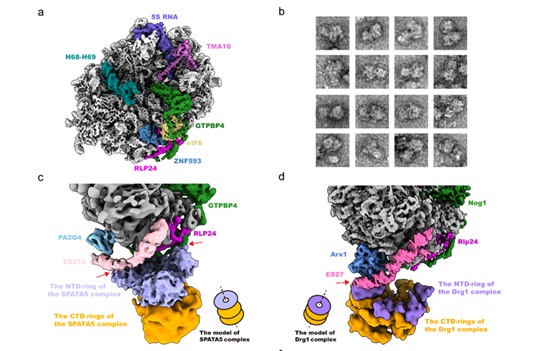
该研究进一步解析了SPATA5复合物结合pre-60S核糖体的超复合物结构。与酵母中Drg1复合物通过N端结构域结合组装因子Arx1和rRNA ES27而被招募到pre-60S不同3,该研究显示人源SPATA5复合物通过NTD环中两侧的CINP分别结合rRNA ES27A以及组装因子GTPBP4而被招募,揭示了人源细胞中pre-60S颗粒对SPATA5复合物独特的招募机制。
图2 SPATA5复合物结合pre-60S前体颗粒结构分析
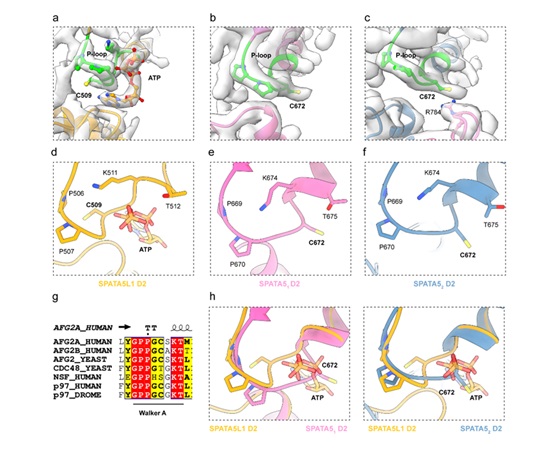
该研究结合Cryo-EM和质谱分析,发现在过表达以及内源SPATA5蛋白Walker A基序中保守的半胱氨酸C672位点都存在高水平亚磺酸化修饰,该氧化修饰导致SPATA5无法有效结合ATP分子,暗示了SPATA5复合物的功能可能受到细胞中氧化还原通路(Redox signaling pathways)调控。线粒体作为细胞内氧化还原信号产生与感应的中心,结合此前关于SPATA5功能与线粒体稳态之间的联系,提示SPATA5蛋白可能作为细胞内氧化还原信号的感受器,协调线粒体稳态调控和核糖体组装过程。
图3 SPATA5复合物中SPATA5与SPATA5L1 D2结构域Walker A基序结构比对
通过与酵母系统进行比较,该研究从SPATA5复合物组成成分、与pre-60S的互作模式和氧化修饰调控三个维度阐明了人源核糖体生物生成的复杂性和种属特异性特征。使用冷冻电镜技术捕捉到的SPATA5复合物和pre-60S形成的超复合物,为SPATA5作为核糖体组装因子提供了确凿的证据。近期,一篇发表的Cell文章4报道了SPATA5复合物通过与DNA复制复合物相关蛋白的相互作用在细胞周期S期维持基因组完整性,然而,多项亚细胞定位研究显示SPATA5蛋白未见细胞核定位2,目前也并没有DNA复制体或相关因子与SPATA5复合物结合的结构证据。核糖体组装缺陷可引发核仁应激,并通过RP-MDM2-p53轴,导致细胞周期阻滞及凋亡等表型1。因此,SPATA5复合物功能丧失所引发的复制应激和染色体不稳定,亦可能为核糖体组装障碍所致的继发效应。
综上所述,本研究系统解析了人源SPATA5复合物的组成与高分辨率三维结构,并结合生化功能验证,揭示了其在核糖体大亚基组装过程中的关键作用。相关结构与功能数据为深入理解SPATA5复合物介导组装因子RLP24解离的分子机制提供了依据,也为揭示高等真核生物核糖体组装的复杂性提供了新的结构线索。此外,该研究成果有望为相关遗传疾病的致病机制研究及潜在药物开发提供理论基础。
高宁、课题组张云阳博士后为本论文通讯作者。前沿交叉学科研究院2020级(PTN)博士研究生戴余浩为本文第一作者。该研究得到了国家自然科学基金、国家重点研发计划、启东-SLS创新基金、北大-清华生命科学联合中心、核糖核酸北京研究中心及膜生物学全国重点实验室的资助支持。北京大学冷冻电镜平台、高性能计算平台、北京大学现代农业研究院冷冻电镜平台、生命科学学院仪器中心及凤凰工程等多个技术平台也为本研究提供了有力保障。
1 Aspesi, A. & Ellis, S. R. Rare ribosomopathies: insights into mechanisms of cancer. Nat. Rev. Cancer 19, 228—238, (2019).
2 Puusepp, S. et al. Compound heterozygous SPATA5 variants in four families and functional studies of SPATA5 deficiency. Eur. J. Hum. Genet. 26, 407—419, (2018).
3 Prattes, M. et al. Visualizing maturation factor extraction from the nascent ribosome by the AAA-ATPase Drg1. Nat. Struct. Mol. Biol. 29, 942—953, (2022).
4 Krishnamoorthy, V. et al. The SPATA5-SPATA5L1 ATPase complex directs replisome proteostasis to ensure genome integrity. Cell 187, 2250—2268, (2024).
文章来源北京大学新闻网,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
北京中兴新景信息技术研究院 23318

-
北京海名会展 18237

-
武汉理工大学 2281

-
国防科技大学 18368

-
湖北武汉大学 18276

-
第十届(2017年)中国金融评论 24151

-
zkppp 8395

-
中国企业国际投资促进会 23201

-
三联公司 18271

-
中国矿业大学电气与动力工程学院 23202

-
武汉市cen主办方 18243

-
哈尔滨工业大学 21604

-
2017教育与发展国际会议(IC 24342

-
RH 8342

-
blythecon 24185

-
上海交通大学 18271

-
重庆邮电大学 23489

-
重庆大学化学化工学院 18261

-
国防科学技术大学 23181

-
上海市同济大学 18402



















 255
255