清华大学生物医学交叉研究院王晓东、郑三多团队合作解析神经轴突退化关键分子开启机制
2025/09/05
在阿尔茨海默病、帕金森病、肌萎缩侧索硬化症(ALS)以及化疗药物导致的神经病变中,轴突退化(axon degeneration)是一个共同且关键的病理事件。与细胞死亡不同,轴突退化往往先于神经元丧失,是神经功能不可逆损伤的重要起点。理解这一过程的分子开关,是神经退行性疾病研究和治疗的关键科学问题。
2012年,马克·弗里曼(Marc Freeman)团队在果蝇与小鼠中证明dSarm/Sarm1对损伤诱导的轴突退化是必需的,确立了SARM1与神经轴突退化的直接因果关系。2015年,米尔布兰特、迪安东尼奥(Milbrandt,Di Antonio)团队发现SARM1激活会在局部引发NAD⁺的快速降解,并足以驱动轴突断裂。2017年,他们进一步证明SARM1的TIR结构域本身具有NADase活性,从酶学层面解释了SARM1触发能量崩溃与轴突解体的分子基础。随后的研究则聚焦在SARM1的激活机制上,目前认为SARM1的激活取决于细胞内NMN/NAD⁺比值的变化,即NMN与NAD⁺在SARM1的ARM结构域异位位点上竞争性结合,前者促活、后者抑制。这些发现使SARM1被确立为轴突退化的分子“开关”,并成为干预神经退行性疾病的重要靶点。
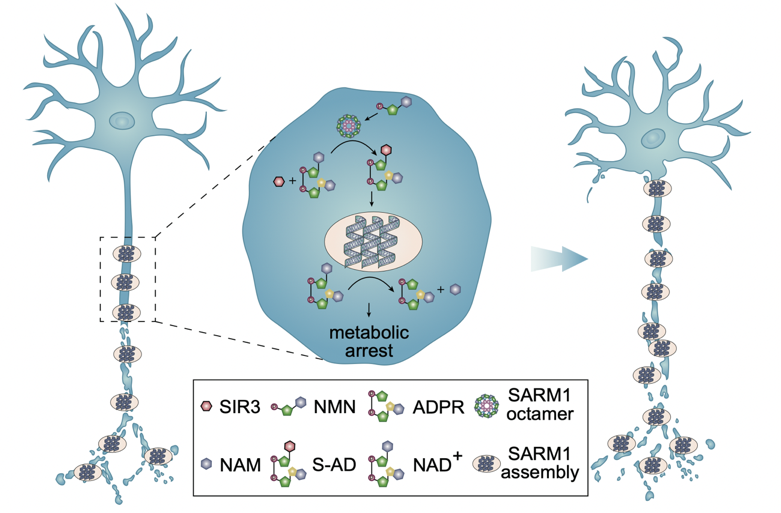
SARM1的激活取决于细胞内NMN/NAD⁺比值的变化虽然成为了主流观点,然而,这一模型无法解释几个关键现象。第一,体外实验需要远高于生理水平的NMN浓度才能激活SARM1;第二,SARM1分布于整个神经元,在轴突病变时激活为何局限在受损的轴突区域,而不是整个神经元。在近期发表的一项研究中,清华大学生物医学交叉研究院的王晓东团队通过系统的生物化学实验,揭示了SARM1激活的分子过程,并提出了一个全新的“两步激活模型”解释了这些现象。第一步,碱基交换反应(Base Exchange):SARM1 TIR结构域利用其固有的催化活性,将NAD⁺中的烟酰胺基团替换为含吡啶基的小分子(如SIR3),生成特定的ADPR-小分子加合物。第二步,相变凝集(Phase Transition):这些加合物作为“分子胶”,促使SARM1 TIR结构域组装成超螺旋丝状结构,并进一步发生液-固相分离,形成稳定的蛋白凝聚体。在这一状态下,SARM1的NADase活性全面释放,引发轴突能量耗竭和解体。
图1.SARM1两步激活促进轴突变性的机制示意图
与此同时,郑三多团队提供了关键的结构生物学证据。他们利用冷冻电镜解析了SARM1在结合ADPR-加合物后的超螺旋丝状体结构,为上述生化机制提供了直接的结构学支撑。有趣的是,这与细菌、植物TIR蛋白通过形成纤维状结构实现催化NAD+水解活性的机制相呼应,提示该激活通路的进化保守性。
图2.TIR结构域结合SIR3-ADPR后形成平行排列的超螺旋结构
这一系列成果不仅解释了SARM1激活的空间限制性,也说明NMN在生理水平下仅起到“引子”作用,轻微提升SARM1活性以启动加合物生成并最终触发完全激活。
研究还发现,一些已进入临床阶段的SARM1抑制剂(如DSRM-3716),在特定浓度下可能反而通过底物交换生成加合物,从而诱导SARM1激活。这种“U型”剂量效应意味着,部分候选药物在某些情况下可能带来神经毒性风险,对长期治疗神经退行性疾病的患者尤其值得关注。因此,未来更为安全有效的策略,可能不是单纯抑制已激活的NADase活性,而是阻止SARM1的priming过程,防止通过碱基交换生成早期ADPR-加合物,并从源头上避免丝状组装和相分离被启动。这种“前置干预”有望更精准地控制SARM1的异常活化,为ALS、化疗诱导神经病变等疾病提供新的治疗思路。
SARM1是轴突退化的“开关分子”。这项研究中,王晓东团队通过生物化学研究提出了激活模型,郑三多团队则通过结构生物学揭示了分子细节。二者研究的结合,不仅刷新了对SARM1生物化学与结构学本质的理解,也为新型药物研发指明了方向。通过针对防止TIR结构域催化活性激活、尤其是防止priming启动过程的精确干预,未来或许能够实现对ALS、化疗诱导神经病变等难治疾病的真正疗效,为患者带来切实希望。
相关研究成果以“SARM1激活通过两步相变促进轴突退化”(SARM1 activation promotes axonal degeneration via a two-step phase transition)为题,于8月22日发表于《自然·化学生物》(Nature Chemical Biology)。
清华大学生物医学交叉研究院研究员王晓东和郑三多为论文通讯作者,王晓东实验室的张文彬博士和2021级博士生周沁怡为论文共同第一作者。论文其他作者还包括郑三多实验室的2022级博士生张隽、蒋辉实验室的2022级博士生王佳晨。研究得到国家自然科学基金委、清华大学生物医学交叉研究院/北京生命科学研究所的经费支持。
文章来源清华大学,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
cmo 21191

-
中国人民大学 2278

-
中南大学土木建筑学院 21278

-
山西财经大学 21352

-
21025

-
成都大学 8489

-
杭州晟凌会务服务公司 18398

-
北京理工大学机械与车辆工程学院 23367

-
上海群天通用电器有限公司 18133

-
科严文化 2191

-
华衡创世(北京)信息咨询有限公司 23316

-
上海电子信息职业技术学院 23266

-
北京科技大学 23300

-
武汉大学经济发展研究中心 23346

-
zkppp 8103

-
机械、电子和工业工程国际学术会议 23216

-
广西先进文化发展促进会 23294

-
武汉cwcn主办方 2320

-
内蒙古呼和浩特 18478

-
2017年经济、管理工程与营销国 21449



















 172
172