山东大学沈月毛/李瑶瑶教授团队、朱德裕副教授合作揭示中链脱氢酶的独特还原环化机制
2025/05/28
近日,药学院沈月毛/李瑶瑶教授团队与基础医学院朱德裕副教授、美国内布拉斯加州立大学化学系杜良成教授合作,在期刊Journal of the American Chemical Society在线发表了题为“Structural basis for medium-chain dehydrogenase/reductase-catalyzed reductive cyclization in polycyclic tetramate macrolactam biosynthesis”的研究成果。硕士研究生谢向前、李凡和穆妍欣为共同第一作者,李瑶瑶教授、朱德裕副教授、杜良成教授和沈月毛教授为共同通讯作者,山东大学药学院为第一完成单位及通讯作者单位。
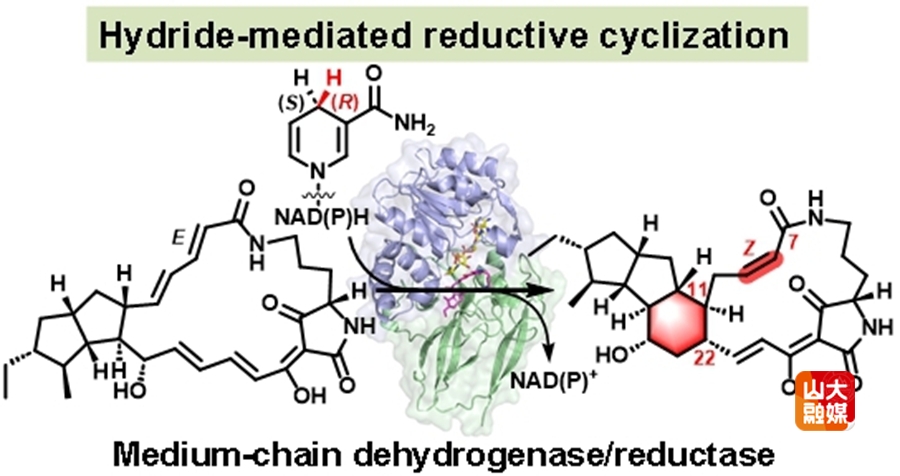
环化反应在天然产物的生物合成中扮演着重要角色,能够生成多样化的分子骨架,同时增强化合物的结构刚性和生物活性。然而,由亲核试剂介导C-C键形成的还原环化反应目前仍相对罕见。中链脱氢/还原酶(MDRs)是一类广泛存在于所有生物体的氧化还原酶,具有高度保守的蛋白质三维结构。这些酶通常作为NAD(P)H-binding的脱氢酶(Zn+依赖)或还原酶(非Zn+依赖)发挥重要作用。值得注意的是,参与多环大环内酰胺(PoTeM)生物合成的MDRs为首类被发现的环化酶。尽管部分PoTeM相关的MDRs已通过体外酶活和同位素标记得以表征,但支撑其环化活性的结构基础和催化机制仍不清楚。
本研究首次解析了PoTeMs相关MDRs家族成员OX4和CftD的apo-及底物复合物结构,并结合突变分析,揭示了其所介导的环化反应机制。我们发现OX4催化反应从NAD(P)H依赖的1,6-还原开始,C7-羰基氧通过水介导的质子化,促使分子内迈克尔加成反应的发生,从而形成C11-C22键,最后通过异构化得到终产物。底物的精确定位以及保守氨基酸W260对烯醇中间体的稳定作用,对于环化反应的顺利进行至关重要。此外,结构比较定位了与底物选择性相关的关键loop区,并通过工程改造实现了CftD的底物选择性改变。这些发现不仅为该类环化酶的结构及催化机制提供了深入理解,也加深了我们对酶促环化过程的认知,对酶工程改造和复杂天然产物的生物合成具有重要意义。
本研究工作得到了国家自然科学基金和山东省自然科学基金的支持。
文章来源山东大学,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
武汉红矮星传媒有限公司 8213

-
百奥泰国际会议(大连)有限公司 2204

-
电子科技大学 8377

-
中国农业大学 23216

-
第五届中国民营经济高峰会 18153

-
西北大学地质学系 23159

-
czqqzx 18193

-
北京市理化分析测试中心 2325

-
上海博蔚会展有限公司 24219

-
郑州金凌商贸有限公司 18305

-
ASDC 24464

-
北京中农智汇投资咨询有限公司 8314

-
湖北华来生物科技有限公司 21159

-
ZZ 8244

-
中华口腔医学会 23245

-
HKSME 24223

-
海南师范大学体育学院 8254

-
武汉青博盛学术服务有限公司 21195

-
北京市大地管理有限公司 18229

-
郑州君健教育咨询有限公司 24160



















 268
268