浙江大学医学院附属邵逸夫医院在肿瘤骨转移机制研究方面取得进展
2024/04/25
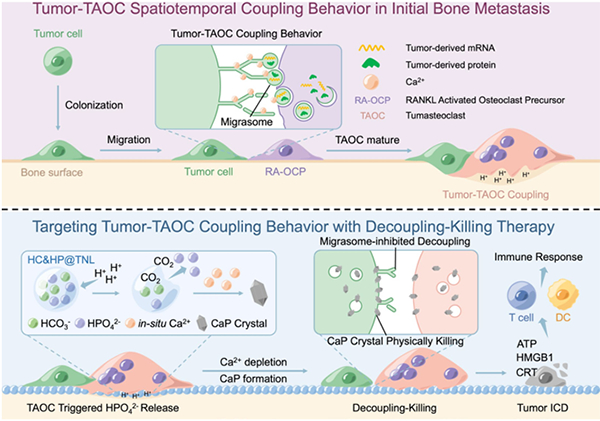 |
图 迁移体介导的肿瘤-TAOC偶联相互作用和HC&HP@TNL解耦杀伤治疗的行为靶向策略模式图
在国家自然科学基金项目(批准号:82072414、82322043)等资助下,浙江大学医学院附属邵逸夫医院林贤丰研究员、范顺武教授研究团队在肿瘤骨转移机制研究方面取得进展。研究成果以“靶向初始肿瘤-破骨时空相互作用以预防肿瘤骨转移(Targeting initial tumour-osteoclast spatiotemporal interaction to prevent bone metastasis)”为题,于2024年3月18日在线发表于《自然•纳米技术》(Nature Nanotechnology)期刊。论文链接:https://doi.org/10.1038/s41565-024-01613-5。
骨是乳腺癌、前列腺癌、肺癌等多种实体瘤的常见转移部位,一旦肿瘤发生骨转移就很难治愈,并且会导致多种并发症的发生,因此深入探索肿瘤细胞骨转移的发生机制,具有重要的临床意义和社会价值。
该研究团队通过体外共培养发现一些破骨细胞可以被肿瘤细胞的直接接触激活,并将其命名为肿瘤相关破骨细胞(Tumour-associated osteoclast,TAOC),继而发现肿瘤细胞-TAOC偶联作用是由迁移体介导的肿瘤胞质转移实现的,并且受到钙离子浓度调节。基于肿瘤-TAOC偶联在初始转移中的时空特征,该团队构建了包裹碳酸氢钠和磷酸氢钠的骨靶向四环素修饰的纳米脂质体(Tetracycline-modified nanoliposomes encapsulating sodium bicarbonate and sodium hydrogen phosphate,HC&HP@TNL)。在肿瘤-TAOC偶联形成的转移初始阶段,由于TAOC的泌酸特性,HC&HP@TNL将被触发并释放高浓度的磷酸氢钠,与微环境中的钙离子结合在原位形成钙磷晶体,降低钙离子浓度以抑制迁移体的形成,从而破坏肿瘤细胞与TAOC的细胞膜完整性,诱导免疫原性细胞死亡,达到物理杀伤效果(图)。
本研究发现了破骨细胞的新亚型—TAOC,并针对性设计了原位钙磷矿化的物理杀伤纳米脂质体,为早期预防肿瘤骨转移提供了新的策略。
文章来源国家自然科学基金委员会,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2025年智能光子学与应用技术国际学 06-10

-
2025年8月优质学术会议推荐 589

-
2025年第十二届能源与环境研究国际 400

-
2025年机械工程,新能源与电气技术 559

-
2025年计算机科学、图像分析与信号 553

-
2025年材料化学与燃料电池技术国际 493

-
第七届精神病学国际大会(CP 202 08-01

-
第七届老龄化与老年医学国际学术会议( 08-01

-
第十四届心理学与健康国际学术研讨会( 08-01

-
第七届测绘与地理信息国际研讨会(CS 08-01

-
第七届大气与海洋科学国际研讨会(SA 08-01

-
第十一届地质灾害研究与防治国际学术会 08-01

-
第十六届地质和地球物理学国际会议(I 08-01

-
第七届细胞科学与再生医学国际研讨会( 08-01

-
第七届合成生物学与生物医学国际研讨会 08-01

-
2025最新JCR分区及影响因子1939

-
好学术:科研网址导航|学术头条分468

-
《时代技术》投稿全攻略:一位审稿499

-
2025年国际期刊预警名单发布!600

-
2025年中科院期刊分区表重磅发3957

-
中科院已正式发布2024年预警期861

-
2025年度国家自然科学基金项目727

-
中国科协《重要学术会议目录(202733

-
2024年国家自然科学基金项目评1138

-
2024年JCR影响因子正式发布1214

-
吉林大学校长张希:学术会议中的提1391

-
SCI论文插图全攻略:从规范解析08-01

-
国际学术会议参加经验是怎么样的呢08-01

-
掠夺性会议是怎么进行判断的呢?—08-01

-
SCI论文投稿费怎么交?202408-01

-
尚体健康科技 1988

-
浙江卧龙房地产 18096

-
北京市海淀区 18053

-
邢台爱尔眼科医院 2010

-
上海市粘接技术协会 21083

-
清华大学 1878

-
广东财经大学国际商学院 8071

-
北京信息名址管理中心 22974

-
科严文化 1894

-
《电子测量与仪器学报》杂志社 23228

-
常州武进假日酒店 21048

-
中国化工企业管理协会 21025

-
PBTSs 2384

-
中国环境科学学会 21043

-
百奥泰国际会议(大连)有限公司- 1981

-
黑龙江省鹤北林业局 17984

-
河南科技学院 1863

-
上海广贸会展服务有限公司 23189

-
北海环球 18091

-
创新实业发张有限公司 18031



















 340
340













































