北京大学生命学院胡家志课题组与合作者追问在体基因编辑的安全性
2024/04/16
近年来,CRISPR-Cas等新一代的基因编辑工具在肿瘤免疫治疗和基因在体治疗等过程中展现出了极大的应用前景。基因编辑工具的优化大概经历三个时期:一是编辑效率和应用范围的提高和拓展;二是脱靶活性的抑制;三是关注基因编辑的基因组毒性,其中主要指染色质结构变异。染色体结构变异包括染色体易位和大片度DNA丢失1。染色体结构变异严重威胁基因组的稳定性并干扰细胞的正常生命活动,进而促使细胞死亡、恶性增殖及癌变等,例如多种淋巴瘤和白血病均由染色体易位导致。2021年,NIH体细胞编辑项目组在Nature撰文,强调关注基因编辑导致的染色体结构变异的重要性和必要性2。同年,因在输注了通用型CAR-T细胞的病人体内发现了由基因编辑导致的染色体易位,美国FDA曾紧急叫停了由Allogene Therapeutics开发的CAR-T细胞疗法的临床研究3。
北京大学生命科学学院、北大-清华生命科学联合中心胡家志研究员课题组的前期研究发现,在用于肿瘤治疗的通用型CAR-T细胞中,Cas9同时编辑多个位点将导致靶位点之间及靶位点与基因组其他位置之间产生高达2%左右的染色体易位,且可在体外培养2周过程中被持续检测4。然而,基因编辑导致的T细胞染色体结构异常在输注至体内后的命运仍是领域空白,这阻碍了基因编辑在临床实践中的大规模应用,并成为持续悬在相关领域头顶的达尔摩斯之剑。
2022年10月16日,胡家志研究员课题组与北京生命科学研究所/清华大学生物医学交叉研究院徐墨研究员课题组在Nucleic Acids Research在线发表了题为“CRISPR/Cas9-induced structural variations expand in T lymphocytes in vivo”的研究论文,全面、定量、长时程地追踪分析了基因编辑导致的T细胞染色体结构异常在输注至小鼠体内后的动态变化。该研究发现,基因编辑导致的染色体易位、染色体大片度丢失和病毒DNA插入在过继给小鼠2个月内,并不会随着时间的延长而消失,而是持续维持在较高水平并展现出明确的随机克隆扩增现象。尤其值得注意的是,部分结构变异甚至可在体内剧烈扩增至数万个拷贝,初现恶性扩增的苗头。

作者利用了徐墨课题组之前建立的小鼠肠炎模型5来研究过继性T细胞中基因编辑导致的染色体结构变异在体内命运。在该体系中,仅表达特异识别Helicobacter hepaticus细菌抗原的TCR 的T细胞,首先在体外激活并被Cas9编辑。成功编辑的细胞将被输注至已经定植了Helicobacter hepaticus的免疫缺陷鼠中,进而诱发T细胞依赖的肠炎(图一),该炎性过程与TCR-T或CAR-T细胞介导的肿瘤免疫治疗高度类似。作者利用胡家志课题组前期开发高灵敏测序方法PEM-seq1,6(Nucleic Acids Research | 胡家志课题组开发全面评估基因编辑产物新方法,详细方案已于2022年发表在STAR protocols7),详细追踪并定量分析了Cas9编辑后的T细胞中的染色体结构异常在输注前、输注3周和2个月后的比例及分布特点。

图一. HH7-2tg小鼠模型模拟TCR-T细胞编辑和输注治疗过程
以危害性最大的染色体易位为例,作者发现,编辑后的T细胞在输注前,其携带的染色体易位占总编辑事件的1%左右(图二A),这与前期在人CAR-T细胞中的结果相当4,并意味着在一次CAR-T细胞治疗中,将至少有数百万个携带染色体易位的T细胞被输注入病人体内。输注入小鼠体内3周和2个月后,染色体易位水平分别维持在0.2~3.36%(7只小鼠,仅有一只为3.36%,其他6只小鼠的最高水平为0.79%)和0.17~0.59%(4只小鼠)(图二A),该发现纠正了领域内前期用灵敏度和准确性有限的PCR做出的发现——染色体易位等结构异常会随着细胞生长而最终消失。此外,Cas9编辑后的T细胞中的染色体易位在输注前相对均匀地分布于基因组上;而输注至小鼠体内3周或2个月后的T细胞中的染色体易位则主要由数个至数十个染色体易位事件组成,表明这些染色体易位随着T细胞的增殖而出现了克隆扩增(该研究共发现128个克隆扩增的染色体易位)(图二B)。尤其值得关注的是,作者在一只小鼠中发现编辑产生的染色体易位产生了20615个克隆(占所有染色体易位事件的72.2%),从而导致其染色体易位水平相比输注前增高了2.4倍(图二C),提示该染色体易位可能促使细胞获得了一定的生长优势(图二D)。

图二. PEM-seq检测炎症T细胞中染色体易位的比例和高频位点
与染色体易位类似,作者发现基因编辑导致的靶位点大片段DNA丢失和病毒DNA插入在输注至小鼠体内前后均分别维持在相近的水平,且表现出随机克隆扩增的特点。同样,作者在一只小鼠中发现一个病毒插入事件可产生30401个克隆,并导致其病毒DNA插入水平相比于输注前增高了近2倍(图三)。
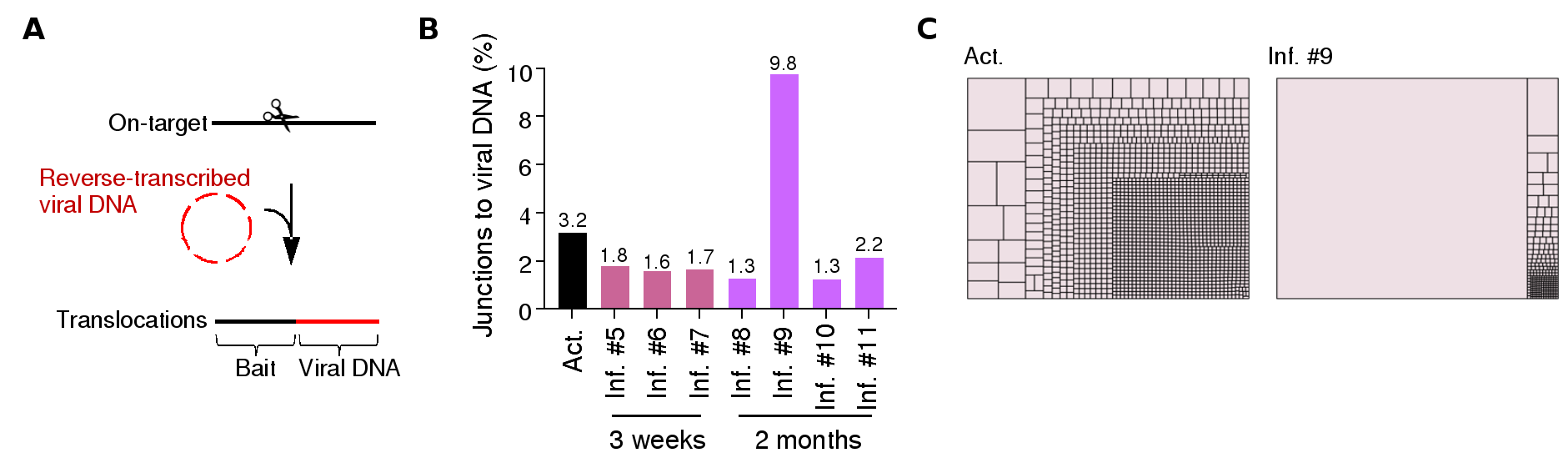
图三. PEM-seq鉴定炎症T细胞中病毒DNA整合及单个病毒DNA位点所占比例
综上,该研究发现基因编辑导致的染色体易位、靶位点的大片段DNA缺失和病毒DNA插入等严重危害基因组稳定性的副产物,在输入至小鼠体内后的2个月内,不仅不会消失,反而在每只接受输注的小鼠(共计16只)中均有部分染色体结构异常发生了剧烈的随机克隆扩增。不仅如此,相比于输注前,该研究在4只(25%)接受输注的小鼠中检测到了更高水平的染色体易位,提示携带有染色体结构异常的T细胞的异常增殖可能会高频发生。因此,该研究不仅为淋巴瘤或白血病中致癌性染色体易位在体内的发展历程提供了启示,而且还提示了采用PEM-seq等方法持续追踪检测基因编辑依赖的过继性细胞疗法(如通用型CAR-或TCR-T,基因编辑后的HSC或胰岛细胞等)或在体基因治疗(黄斑病变等)中基因编辑产物在体内动态变化及命运的必要性。此外,该研究还启示使用更安全基因编辑工具的必要性,如可将染色体结构异常降低至背景水平的Cas9TX等4(NatureCommunications | 胡家志研究组开发目前最安全的Cas9基因编辑工具变体Cas9TX)。
胡家志、课题组刘阳博士和徐墨为该文章的共同通讯作者。胡家志课题组博士研究生吴锦淳,徐墨课题组博士研究生邹梓晔以及刘阳为该文章的共同第一作者,胡家志课题组博士研究生刘栩豪和张丁峥嵘在该工作中亦有重要贡献。该工作得到了中国农业农村部、北大-清华生命科学联合中心、科技部国家重点研发计划、国家自然科学基金、细胞增殖与分化教育部重点实验室、北京大学生命科学学院仪器中心(成像平台及流式平台)、北京生命科学研究所/清华大学生物医学交叉研究院以及北京市科委的大力支持。
参考文献:
1.Liu, M. et al. Global detection of DNA repair outcomes induced by CRISPR–Cas9. Nucleic Acids Research 49, 8732-8742, doi:10.1093/nar/gkab686 (2021).
2. Saha, K. et al. The NIH Somatic Cell Genome Editing program. Nature 592, 195-204, doi:10.1038/s41586-021-03191-1 (2021).
3. Sheridan, C. Off-the-shelf, gene-edited CAR-T cells forge ahead, despite safety scare. Nat Biotechnol 40, 5-8, doi:10.1038/d41587-021-00027-1 (2022).
4. Yin, J. et al. Cas9 exo-endonuclease eliminates chromosomal translocations during genome editing. Nat Commun 13, 1204, doi:10.1038/s41467-022-28900-w (2022).
5. Xu, M. et al. c-MAF-dependent regulatory T cells mediate immunological tolerance to a gut pathobiont. Nature 554, 373-377, doi:10.1038/nature25500 (2018).
6. Yin, J. et al. Optimizing genome editing strategy by primer-extension-mediated sequencing. Cell discovery 5, 1-11, doi: 10.1038/s41421-019-0088-8 (2019).
7. Liu, Y. et al. PEM-seq comprehensively quantifies DNA repair outcomes during gene-editing and DSB repair. STAR Protocols 3, 101088, doi:https://doi.org/10.1016/j.xpro.2021.101088 (2022).
文章来源北京大学新闻网,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026资源、化学化工与应用材料国际 218

-
2026年智能制造与光学传感技术国际 235

-
2026年2月高录用率国际学术会议列 37

-
2026年第六届土木工程与建筑国际会 841

-
2026年图像处理与数字创意设计国际 90

-
2026年机械工程,新能源与电气技术 4589

-
2026年材料科学、低碳技术与动力工 307

-
2026年第二届无线与光通信国际会议 1149

-
2026 9th Internati 01-15

-
2026年土木工程智能建造与基础设施 01-15

-
2026年环境工程、生态修复与可持续 01-15

-
2026年数字健康、远程医疗与智能诊 01-15

-
2026年金融科技、智能风控与数字资 01-15

-
2026年智慧农业、食品工程与供应链 01-15

-
2026年计算建模、数学与大数据国际 01-15

-
2025年两院院士增选有效候选人2854

-
2025最新JCR分区及影响因子7970

-
好学术:科研网址导航|学术头条分3741

-
2025年国际期刊预警名单发布!3763

-
2025年中科院期刊分区表重磅发13927

-
中国科协《重要学术会议目录(208283

-
吉林大学校长张希:学术会议中的提4800

-
清华大学物理系徐勇、段文晖研究组12-25

-
清华大学-上汽通用五菱汽车人工智12-25

-
参加学术会议学术蝗虫_参加学术会12-25

-
参加学术会议图片_参加学术会议需12-25

-
参加学术会议投稿邮件_参加学术会12-25

-
参加学术会议文学_参加学术会议有12-25

-
参加学术会议文案_参加学术会议文12-25

-
参加学术会议违法_参加学术会议违12-25

-
中金岭南韶关冶炼厂 18240

-
徐州工程学院 8398

-
武汉千学信息咨询有限公司 8342

-
黄河科技学院 24198

-
Focussend 24148

-
RH 8128

-
梵净山红豆杉开发有限公司 18194

-
黑龙江大学水利电力学院 2550

-
北京富来宫温泉山庄 2077

-
天津大学 8506

-
中铁十六局集团 18401

-
丝绸之路国际和平智库 8322

-
河南省滑县人民医院 23103

-
上海商图信息咨询有限公司 8160

-
上海聚亿展览服务有限公司 2132

-
文化发展有限公司 24218

-
武汉青博盛学术服务有限公司 21129

-
武汉工程大学 23264

-
上海易标科技 18606

-
国际智能信息技术应用学会IITA 18344



















 885
885














































