我国学者在基于纳米孔道天然蛋白质精准测量方面取得新进展
2025/06/01
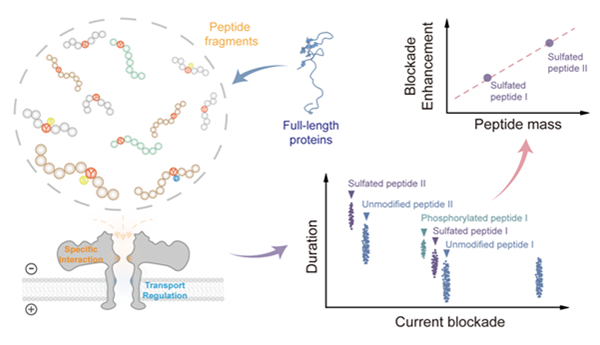
图 纳米孔道鉴定蛋白质酪氨酸硫酸化翻译后修饰示意
在国家自然科学基金项目(批准号:22027806)资助下,南京大学龙亿涛教授团队在天然多肽/蛋白质酪氨酸硫酸化翻译后修饰检测方面取得新进展。研究成果以“基于纳米孔道的酪氨酸硫酸化状态直接测量(Direct Mapping of Tyrosine Sulfation States in Native Peptides by Nanopore)”为题,于2024年9月25日在《自然•化学生物学》(Nature Chemical Biology)发表。论文链接:https://doi.org/10.1038/s41589-024-01734-x。
酪氨酸硫酸化作为一种重要的蛋白质翻译后修饰,对蛋白质-蛋白质相互作用调控及多种生理和病理过程至关重要。研究表明,约1%的酪氨酸残基可能被硫酸化,然而,由于检测方法的限制,迄今仅有约160种酪氨酸硫酸化蛋白质被实验鉴定,大量重要硫酸化蛋白及其功能有待检测发现与阐明。目前,酪氨酸硫酸化检测的难点主要在于三个方面:首先,酪氨酸硫酸化对温度和pH敏感,容易在质谱检测中丢失;其次,酪氨酸的另一种翻译后修饰——磷酸化,与硫酸化仅存在微小的分子量差异(仅差0.0095 Da),使得检测的特异性和灵敏度都受到限制;此外,硫酸化蛋白质丰度极低,且在纯化分离过程中的低稳定性进一步增加了检测的复杂性和难度。因此,亟需发展一种单分子测量技术,能够直接且精准地鉴定天然蛋白中的酪氨酸硫酸化状态。
针对此问题,研究团队在仪器研制项目资助研发的“纳米孔道单分子蛋白质测序仪器系统”上,发展了一种通用型蛋白质酪氨酸硫酸化检测方法,能够在无需纯化分离的条件下,直接鉴定并定量混合体系中的低丰度硫酸化酪氨酸,突破了现有纳米孔道检测技术仅适用于测定特定已知多肽序列、难以应用于实际未知蛋白质分析的局限。同时,结合全原子分子动力学模拟,验证了硫酸化诱导的非共价相互作用增强机制,证明了这种纳米孔道序列非依赖性硫酸化识别策略的可靠性,为进一步鉴定未知的酪氨酸硫酸化蛋白质提供了强有力的分析工具。
文章来源国家自然科学基金委员会,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026年第八届计算机科学与技术在教 109

-
2026年3月高含金量国际学术会议合 88

-
2026资源、化学化工与应用材料国际 1265

-
2026年人工智能教育技术与数据科学 246

-
2026年图像处理与数字创意设计国际 1041

-
2026年机械工程,新能源与电气技术 5524

-
2026年材料科学、低碳技术与动力工 1312

-
2026年第二届无线与光通信国际会议 2080

-
第七届多组学科研与临床应用大会 02-05

-
2026年制药学、生物技术与植物学国 02-04

-
2026年节能技术、低碳发展与可持续 02-04

-
2026年导航控制、传感技术与卫星应 02-04

-
2026年经济转型与商业文化国际学术 02-04

-
2026年体育科学、运动健康与创新管 02-04

-
2026创意城市、设计与社区建设国际 02-04

-
2025年两院院士增选有效候选人4066

-
2025最新JCR分区及影响因子10070

-
好学术:科研网址导航|学术头条分5098

-
2025年国际期刊预警名单发布!5129

-
2025年中科院期刊分区表重磅发16711

-
中国科协《重要学术会议目录(2010250

-
吉林大学校长张希:学术会议中的提6245

-
bbrc期刊,bbrc期刊处于S02-03

-
siam期刊,siam期刊发的最02-03

-
了望期刊,瞭望期刊02-03

-
共享经济期刊,共享经济学术论文02-03

-
期刊代理网,从哪里找期刊代理02-03

-
light期刊,Light期刊综02-03

-
传承 期刊,传承期刊投稿点评02-03

-
期刊勘误,期刊勘误时会索要原始数02-03

-
香港机械工程师协会 23199

-
湖北研学博科文化传播有限公司 8368

-
广州中医药大学 24357

-
香港机械工程师协会 2158

-
武汉华联帕博文化传播有限公司 2231

-
全国卫生产业企业管理协会抗菌产业 23184

-
北京中外视觉艺术院 1769

-
经济技术开发区大连大学 18282

-
西北大学地质学系 23159

-
上海麦峰医学 24395

-
上海天马微电子有限公司 23190

-
宜昌致尚会务会展有限公司 24190

-
Elsevier 21396

-
北京未来开创有限公司 2084

-
岭南师范学院 8559

-
西安科技大学 23422

-
北京正清然科技有限公司 18344

-
北京恒跃展览有限公司 8340

-
沈阳博思教育咨询有限公司 23287

-
张家界国旅国际旅行社有限公司 2150



















 268
268