浙江大学与海外合作者在糖基化修饰调控YTHDF蛋白生物学功能领域取得进展
2024/03/29
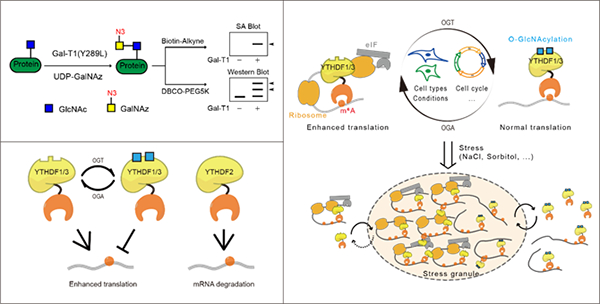 |
图 定量检测YTHDF蛋白的翻译后修饰,揭示其分子机制与生物学功能
在国家自然科学基金项目(批准号:22222705、91953113、92253302、22277080)资助下,浙江大学林世贤团队、深圳湾实验室葛韵团队与芝加哥大学何川团队合作,在高化学计量O-GlcNAc修饰的功能研究方面取得新进展,相关成果以“O-GlcNAc修饰调控YTHDF蛋白的翻译促进功能与相分离(O-GlcNAcylation determines the translational regulation and phase separation of YTHDF proteins)”为题,于2023年11月9日在《自然细胞生物学》(Nature Cell Biology)杂志上发表。论文链接:https://www.nature.com/articles/s41556-023-01258-X。
N6-methyladenosine (m6A) 是mRNA上最丰富的转录后修饰,在生理、病理过程中发挥着重要作用。YTHDF家族蛋白是细胞质中m6A的重要读码蛋白,但其功能调控机制尚不明确。林世贤等人提出通过定量检测YTHDF蛋白质的翻译后修饰以阐释YTHDF蛋白的功能机制,研究发现:(1)仅在YTHDF1/3蛋白(而非YTHDF2蛋白)上鉴定到高丰度的O-GlcNAc糖基化修饰;(2)高丰度的O-GlcNAc修饰干扰YTHDF1/3蛋白对翻译促进因子的招募,进而抑制其对底物m6A-RNA的翻译促进功能;(3)在不同细胞系、细胞周期以及细胞环境下,糖基化修饰的丰度存在着可逆的动态变化并调控了YTHDF1/3蛋白的功能;(4)O-GlcNAc糖基化修饰是调控YTHDF1/3相分离的组装、动态过程和解聚的关键因素(图)。
该研究阐释了O-GlcNAc修饰可逆调控YTHDF1/3蛋白功能的新机制,发现了YTHDF的O-GlcNAc修饰调节相分离性质的规律,为YTHDF家族蛋白的功能研究提供了更为完善的新机制。
文章来源国家自然科学基金委员会,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2026资源、化学化工与应用材料国际 218

-
2026年智能制造与光学传感技术国际 235

-
2026年2月高录用率国际学术会议列 37

-
2026年第六届土木工程与建筑国际会 841

-
2026年图像处理与数字创意设计国际 90

-
2026年机械工程,新能源与电气技术 4589

-
2026年材料科学、低碳技术与动力工 307

-
2026年第二届无线与光通信国际会议 1149

-
2026 9th Internati 01-15

-
2026年土木工程智能建造与基础设施 01-15

-
2026年环境工程、生态修复与可持续 01-15

-
2026年数字健康、远程医疗与智能诊 01-15

-
2026年金融科技、智能风控与数字资 01-15

-
2026年智慧农业、食品工程与供应链 01-15

-
2026年计算建模、数学与大数据国际 01-15

-
2025年两院院士增选有效候选人2854

-
2025最新JCR分区及影响因子7970

-
好学术:科研网址导航|学术头条分3741

-
2025年国际期刊预警名单发布!3763

-
2025年中科院期刊分区表重磅发13927

-
中国科协《重要学术会议目录(208283

-
吉林大学校长张希:学术会议中的提4800

-
清华大学物理系徐勇、段文晖研究组12-25

-
清华大学-上汽通用五菱汽车人工智12-25

-
参加学术会议学术蝗虫_参加学术会12-25

-
参加学术会议图片_参加学术会议需12-25

-
参加学术会议投稿邮件_参加学术会12-25

-
参加学术会议文学_参加学术会议有12-25

-
参加学术会议文案_参加学术会议文12-25

-
参加学术会议违法_参加学术会议违12-25

-
中铁绿建控股有限公司 23273

-
山东诚城园区运营管理有限公司 8314

-
湖北省众科自然科学研究院有限公司 9327

-
四川大学网络空间安全研究院 23237

-
青岛大学交流中心会议酒店 18421

-
杭州宝盛水博园大酒店有限公司 2217

-
上海聚亿展览服务有限公司 23221

-
fdcv 23178

-
受不鸟会展公司 23185

-
华中师范大学 18184

-
美国科研出版社 2286

-
武汉科严文化发展有限公司 23167

-
天津天盛贵金属有限公司 18113

-
中华中医药学会 21233

-
西北工业大学 18350

-
国际工学技术出版协会 2250

-
中华口腔医学会 23556

-
中国化学化工行业中心 24338

-
中国水利技术信息中心 24379

-
环旅国际控股 23321



















 709
709














































