清华大学生命学院周帆课题组揭示胚胎着床期DNA甲基化与转录的动态共舞机制
2025/06/13
哺乳动物胚胎的着床前后转变(Pre- to post-implantation transition, PPT)是早期胚胎发育过程中的关键生物学事件。在这个发育窗口期,胚胎经历剧烈的发育重编程,在细胞和分子水平发生一系列精密调控事件,例如多能性状态的转变、第二次细胞命运决定、前后对称性打破、大规模的表观遗传重编程等。
近年来,少量细胞或单细胞组学测序和分析技术的进展,极大推动了早期发育分子动态图景的绘制与理解,多个研究组曾报道哺乳动物胚胎在早期发育过程中DNA甲基化(DNA methylation,DNAme)的动态特征。然而该过程是否在物种间保守,以及哺乳动物胚胎PPT过程中DNAme和与基因表达(RNA expression,RNAex)如何协同调控、是否影响谱系命运转变,其机制有待进一步揭示。
6月3日,清华大学生命学院、清华-北大生命联合中心周帆副教授课题组在《细胞报告》(Cell Reports)在线发表了题为“解析早期哺乳动物发育中DNA甲基化-转录的着床前后转变”(Dissecting pre- to post-implantation transition of DNA methylome-transcriptome dynamics in early mammalian development)的研究论文。该研究结合高精度多组学挖掘与体内外模型验证等体系,从围着床胚胎主要谱系及其亚群特异性DNA加甲基化模式、基因组元件上父母源DNAme差异、启动子DNAme与RNAex协同变化等多个角度,系统解析了围着床胚胎DNAme和RNAex协同动态调控模式。
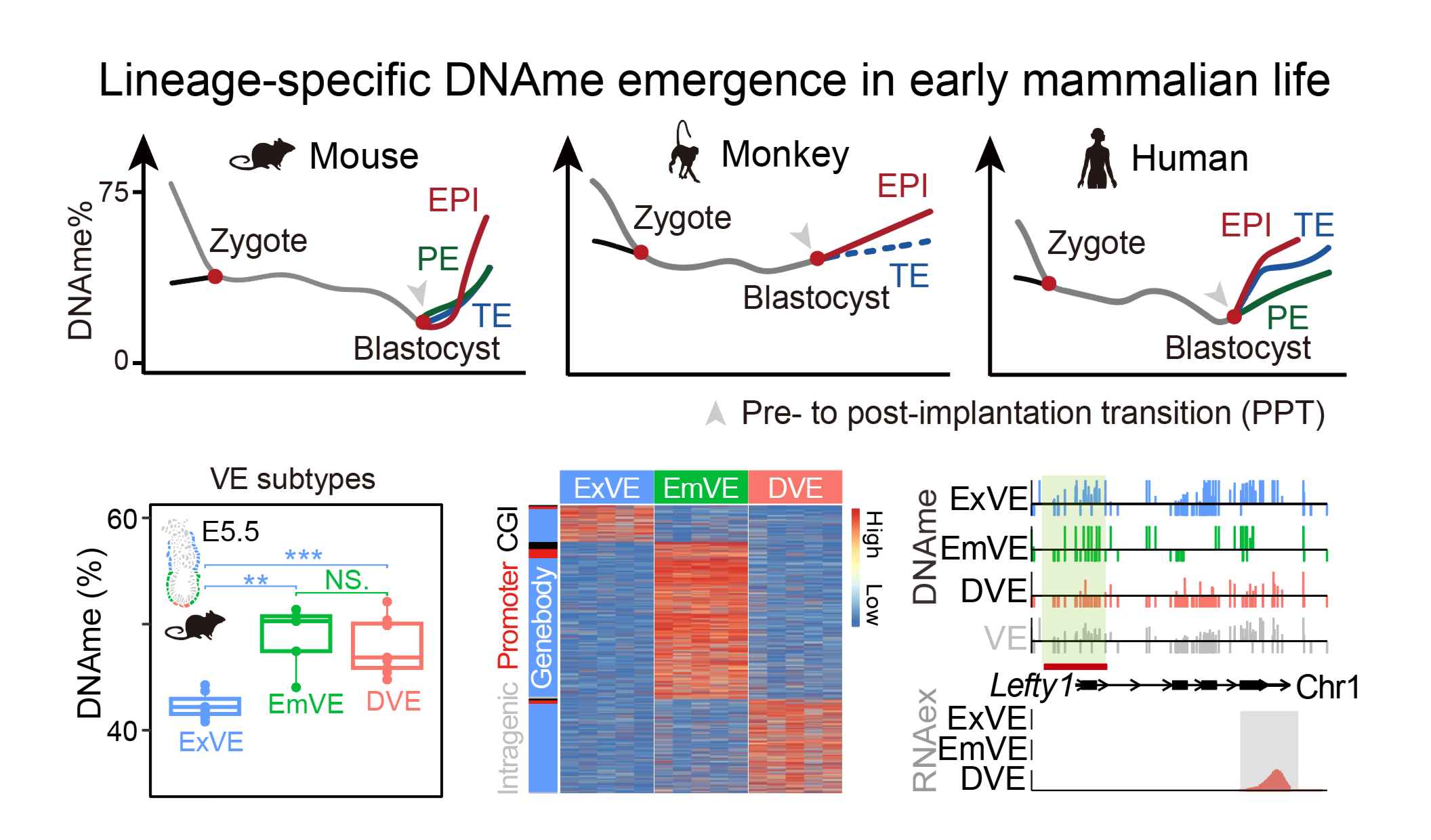
研究人员通过多组学测序中的RNA测序分别挑选出E3.5-E5.5小鼠胚胎细胞用于单细胞DNAme测序,结果显示着床后谱系均经历了全基因组甲基化水平的剧烈升高,其中胚内谱系(胚胎上胚层(epiblast,EPI))的DNAme重建速度与水平显著高于胚外谱系(内脏内胚层(visceral endoderm,VE)和胚外外胚层(extraembryonic ectoderm,ExE))。小鼠、猴和人类在受精后都经历了全基因组去甲基化过程,并在围着床阶段降至最低水平,着床后重新建立谱系特异的DNAme模式。此外,VE亚群在基因组元件和VE亚群特异表达基因上均呈现出差异DNAme,表明VE亚群命运决定过程中也经历了各自的DNAme动态变化(图1)。
图1.哺乳动物早期谱系特异性DNAme的出现
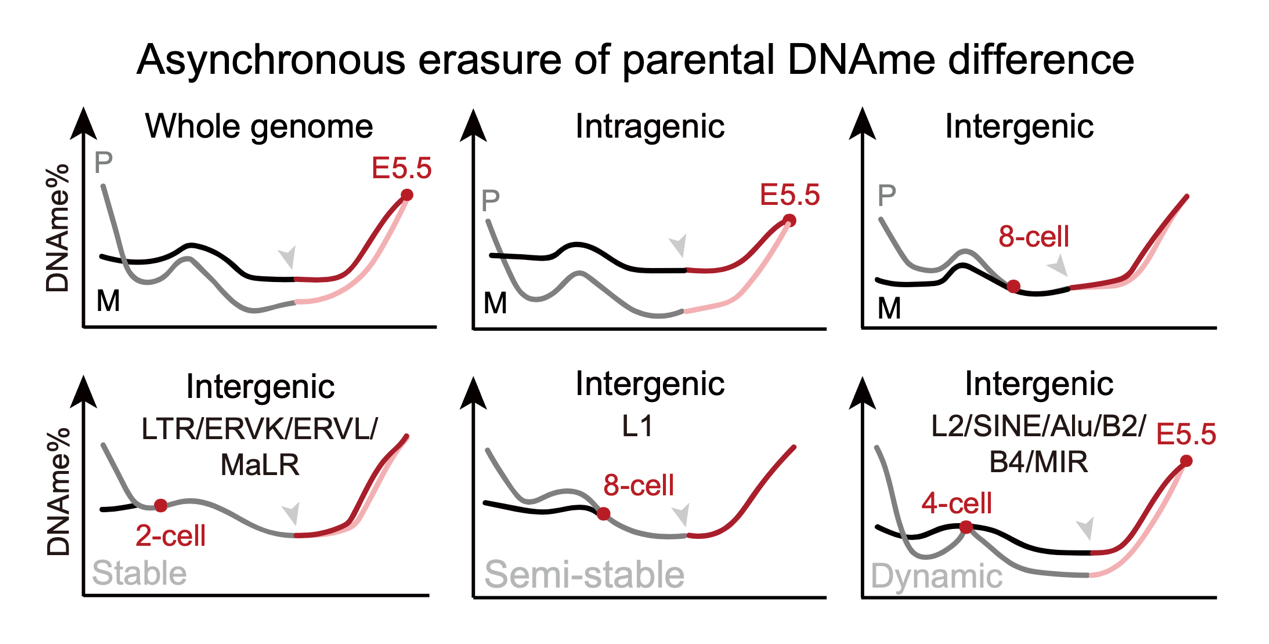
父母源差异性DNAme在印记基因的表达和转座元件的不对称沉默中发挥重要作用,然而哺乳动物早期发育中该差异贯穿PPT全程的规律仍未被系统揭示。研究人员发现早期胚胎发育过程中父母源DNAme差异的消失呈现出元件亚型特异性的时序差异,且这一现象与小鼠的性别和品系无关。值得注意的是,各类父母源基因组元件(尤其是转座子、逆转座子等区域)的异步动态变化,是否参与早期胚胎基因表达调控并影响谱系命运值得关注(图2)。
图2.早期胚胎发育中父母源DNAme差异的异步擦除
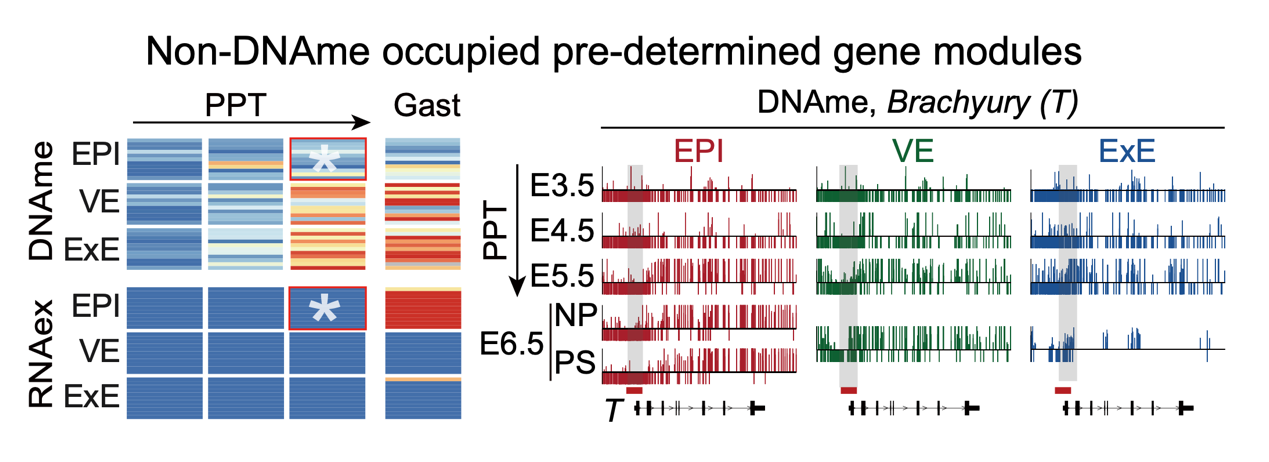
启动子差异DNAme分析显示,E5.5胚胎存在EPI特异性低DNAme启动子,相关基因显著富集于E6.5原肠胚形成等关键发育通路。例如原肠运动相关基因Brachyury(T)在E5.5 EPI中提前形成EPI特异性低DNAme,并在E6.5原条(primitive streak, PS)中特异性激活表达。VE/ExE特异性低甲基化启动子相关基因主要参与调控消化系统与胎盘发育。这些谱系特异性启动子低甲基化基因与后续谱系特化和细胞命运决定密切相关,提示启动子甲基化状态可能通过“表观遗传预编程”机制预先调控各谱系基因开关,从而限制细胞向非目标谱系分化(图3)。
图3. 非DNA甲基化占据预设基因模块的建立
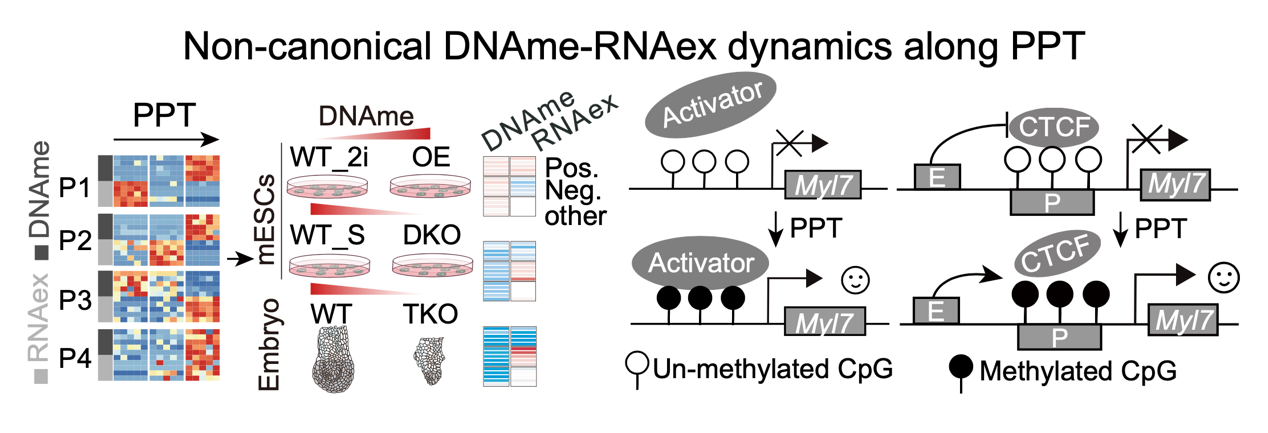
整合分析表明,围着床期EPI中大部分基因呈现经典DNAme-RNAex负相关模式(即启动子高甲基化抑制基因表达)。同时,少量基因存在启动子甲基化与RNAex正协同变化模式,且该模式在小鼠和人类各谱系中保守。通过过表达/敲除Dnmt3a/b的mESCs模型及分析Dnmt1/3a/3b三敲胚胎EPI,进一步验证此类非经典DNAme-RNAex正协同模式在干细胞和胚胎发育中的普适性。多维度调控因子分析提示,该表观遗传调控模式可能通过排斥CTCF、招募特异性激活因子(如Znf692)等多维分子机制共同调控谱系发育基因表达(图4)。
图4.着床前后转变中的非经典DNA甲基化和转录动态的形成
该研究揭示了围着床胚胎谱系特异的DNAme动态变化及VE亚群DNAme差异模式;解析了不同基因组元件上父母源DNAme差异的非同步消失规律;鉴定了围着床期启动子DNAme-RNAex的多样化动态模式,特别发现一类DNAme-RNAex正协同变化的非经典分子特征,为理解胚胎发育中表观遗传与基因表达的互作关系提供了新视角。
周帆为论文通讯作者,周帆课题组2023级博士生朱庆元和2021级博士生刘莹为论文共同第一作者。参与这一工作的还有生命学院2023级博士生郝鑫、2020级博士生鄢胜镒、2020级博士生葛吉涛和2023级博士生郑长青。研究得到昌平国家实验室任仙文研究员的大力支持。
文章来源清华大学,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2025年智能光子学与应用技术国际学 06-10

-
2025年8月优质学术会议推荐 589

-
2025年第十二届能源与环境研究国际 400

-
2025年机械工程,新能源与电气技术 559

-
2025年计算机科学、图像分析与信号 553

-
2025年材料化学与燃料电池技术国际 493

-
第七届精神病学国际大会(CP 202 08-01

-
第七届老龄化与老年医学国际学术会议( 08-01

-
第十四届心理学与健康国际学术研讨会( 08-01

-
第七届测绘与地理信息国际研讨会(CS 08-01

-
第七届大气与海洋科学国际研讨会(SA 08-01

-
第十一届地质灾害研究与防治国际学术会 08-01

-
第十六届地质和地球物理学国际会议(I 08-01

-
第七届细胞科学与再生医学国际研讨会( 08-01

-
第七届合成生物学与生物医学国际研讨会 08-01

-
2025最新JCR分区及影响因子1939

-
好学术:科研网址导航|学术头条分468

-
《时代技术》投稿全攻略:一位审稿499

-
2025年国际期刊预警名单发布!600

-
2025年中科院期刊分区表重磅发3957

-
中科院已正式发布2024年预警期861

-
2025年度国家自然科学基金项目727

-
中国科协《重要学术会议目录(202733

-
2024年国家自然科学基金项目评1138

-
2024年JCR影响因子正式发布1214

-
吉林大学校长张希:学术会议中的提1391

-
SCI论文插图全攻略:从规范解析08-01

-
国际学术会议参加经验是怎么样的呢08-01

-
掠夺性会议是怎么进行判断的呢?—08-01

-
SCI论文投稿费怎么交?202408-01

-
新疆大学 8111

-
湖北杰瑞文化传播有限公司 23880

-
北京理工大学 24100

-
北京泰格尔展览有限公司 23930

-
第八届电子与信息工程国际会议 21425

-
中国农科院资源区划所 20957

-
中国园艺学会 17932

-
西北工业大学 7988

-
厦门薪源会展服务有限公司 17888

-
中国科学院广州地球化学研究所 22904

-
东北电力大学科研处 20983

-
中国农学会 21145

-
湖北研学博科文化传播有限公司 7964

-
WILL 7823

-
上海博蔚会展有限公司 20861

-
上海来溪会务服务有限公司 8015

-
DDEA 21008

-
江西理工大学 21049

-
南开大学化学学院 18096

-
北京乾圆国学文化研究院 2018



















 88
88