清华大学生命学院陈春来课题组合作揭示配体效能调控µ型阿片受体构象动态变化的分子机制
2024/04/25
在临床治疗领域,吗啡和芬太尼等阿片类药物是目前临床上最常用的强效镇痛药,它们通过激活脑内的µ型阿片受体(µOR)产生镇痛效果。然而,阿片类药物的长期使用可能导致依赖性、耐受性增加以及严重的副作用,如便秘和致死的呼吸抑制。因此,解析µOR的激活机制及其与不同药物的相互作用对开发新型镇痛药物具有重要的理论和实际意义。
4月10日,清华大学生命科学学院陈春来课题组与斯坦福大学布赖恩·科比尔卡(Brian Kobilka)课题组、加州大学洛杉矶分校韦恩·哈贝尔(Wayne Hubbell)课题组合作,以“配体效能调控µ型阿片受体的构象动态”(Ligand efficacy modulates conformational dynamics of the µ-opioid receptor)为题,在《自然》(Nature)上发文。通过采用先进的双电子-电子共振(DEER)和单分子荧光共振能量转移(smFRET)技术,揭示了µOR在不同配体和胞内下游信号蛋白作用下的重要亚稳态构象和构象之间的动态变化。研究发现,配体通过调节µOR在不同亚稳态构象之间的动态平衡,进而影响受体对细胞内信号分子的激活能力,即内在效能。
µOR属于G蛋白偶联受体(GPCR)家族,这是一类广泛存在于细胞表面,通过接收外部信号并启动细胞内响应的膜蛋白。GPCR家族的成员参与了多种生命过程,从视觉和嗅觉到神经传递和细胞内信号转导,因而成为了众多药物开发的靶点。从科比尔卡课题组2007年发表第一个非视紫红质的GPCR(β2AR)结构以及2011年发表第一个GPCR-G蛋白复合物结构至今,不断涌现的GPCR与配体以及胞内信号蛋白的高分辨率结构极大增强了科学人员对GPCR结构和功能的理解。作为一类复杂的、高度动态的别构调控膜蛋白,GPCR在配体作用下可在不同构象之间变化,进而激活下游的G蛋白或者招募β-arrestin(图1)。然而,X射线晶体学和冷冻电镜(Cryo-EM)等结构生物学方法只能捕获GPCR最稳定的构象。那些可能决定了GPCR功能的中间态构象或者低比例的构象却难以被捕捉。相比之下,DEER技术能在亚埃级分辨率下获得蛋白的不同构象及其比例,而smFRET技术能够实时地获得蛋白构象动态变化的信息。因此,这两项技术在空间解析和时间解析方面相互补充,有效地揭示了µOR与配体相互作用以及激活下游信号蛋白的分子机制。
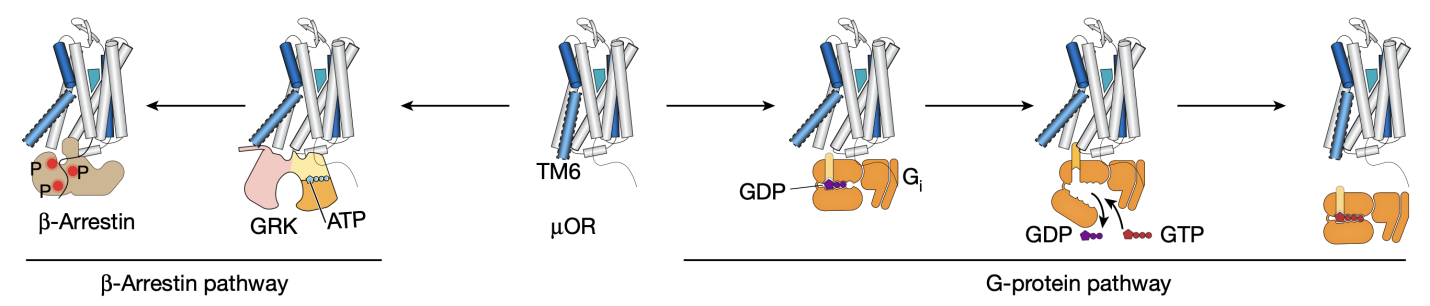
图1.µ型阿片受体(µOR)与下游信号
研究人员首先使用一种新型的硝基氧自由基标记物来标记µOR的第四和第六跨膜螺旋(TM4和TM6)的胞内端。通过DEER技术,研究人员获得了µOR在吗啡等九种不同配体以及胞内信号蛋白G蛋白或者β-arrestin存在时的构象分布(图2)。结果显示,µOR存在四种不同的构象,其中两种构象为抑制状态(命名为R1和R2),两种构象为激活状态(R3和R4)。然而,以往的晶体学和冷冻电镜研究只揭示了一种抑制状态和一种激活状态的构象。通过对比不同条件下µOR的构象分布,研究人员发现,与低效能(low efficacy)配体(如TRV130)相比,高效能(high efficacy)配体(如lofentanil)在没有下游G蛋白结合时,就能够明显增加µOR在激活状态的比例。但是当有G蛋白存在时,不同效能的配体均能稳定µOR的R3和R4激活状态构象,以R3构象为主。这表明配体的效能与其单独存在时稳定激活状态构象的能力相关。与G蛋白相比,β-arrestin结合µOR的能力较差,且主要结合µOR的R4构象,这一方面说明µOR可能以不同的构象结合G蛋白和β-arrestin,另一方面展示了高效能的配体能更强地招募β-arrestin的原因是其能够增加R4状态的比例。
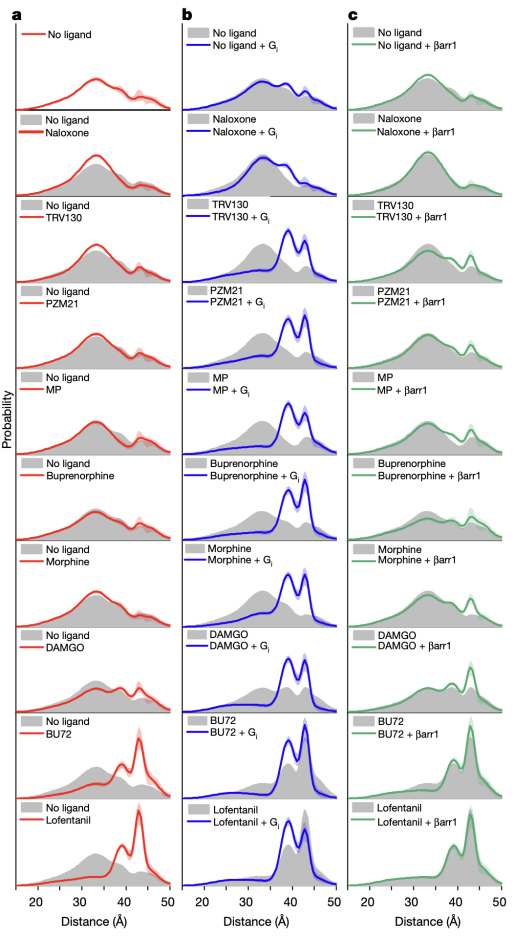
图2.双电子-电子共振(DEER)揭示的µOR的构象变化
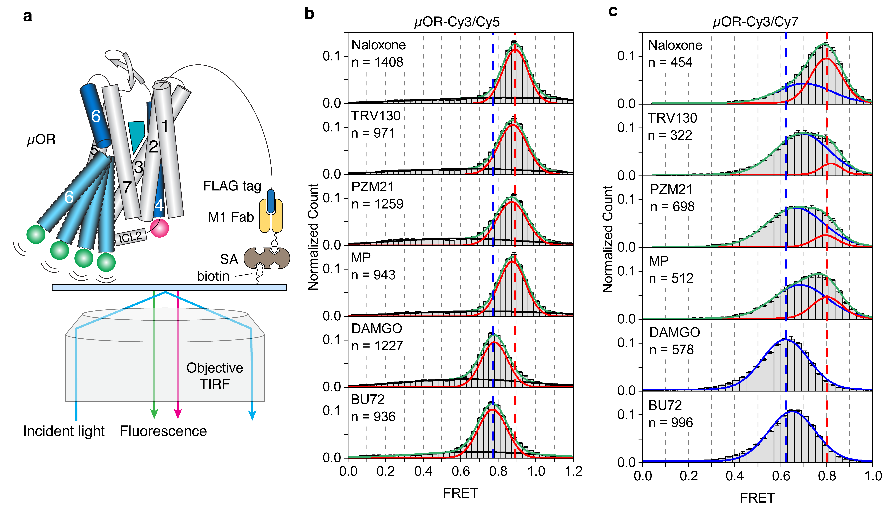
图3.smFRET实验揭示的µOR的构象分布
不同效能的配体如何通过调控µOR的构象变化来影响下游G蛋白信号的呢?研究人员使用荧光分子标记µOR的TM4和TM6,并且使用smFRET技术观测µOR在不同配体和G蛋白、GDP存在时的构象分布及变化速率(图3和图4)。与DEER的结果相一致,smFRET实验结果显示,µOR在低效能配体存在时更倾向于抑制状态,而在高效能配体存在时更倾向于激活状态。当研究人员标记µOR的第二个胞内环圈(ICL2)而不是TM4时,smFRET观测到了拮抗剂或者低效能配体结合的µOR存在两个状态,其构象变化可能与配体的低效能相关。研究人员进一步实时观测了在有G蛋白和不同浓度GDP存在时µOR在激活状态和抑制状态之间的变化(图4)。数据分析显示,结合G蛋白时,µOR存在两个激活状态,分别对应了两种G蛋白的状态:结合GDP的G蛋白(EFRET=0.6)和不结合GDP的G蛋白(EFRET=0.5)。与低效能的配体相比,高效能配体增加了结合不含GDP的G蛋白的µOR比例,即更容易使G蛋白的GDP释放从而结合GTP,进而激活G蛋白。此外,高效能配体能促使µOR快速地结合G蛋白,并且增加G蛋白结合的稳定性从而增加GTP结合的概率。
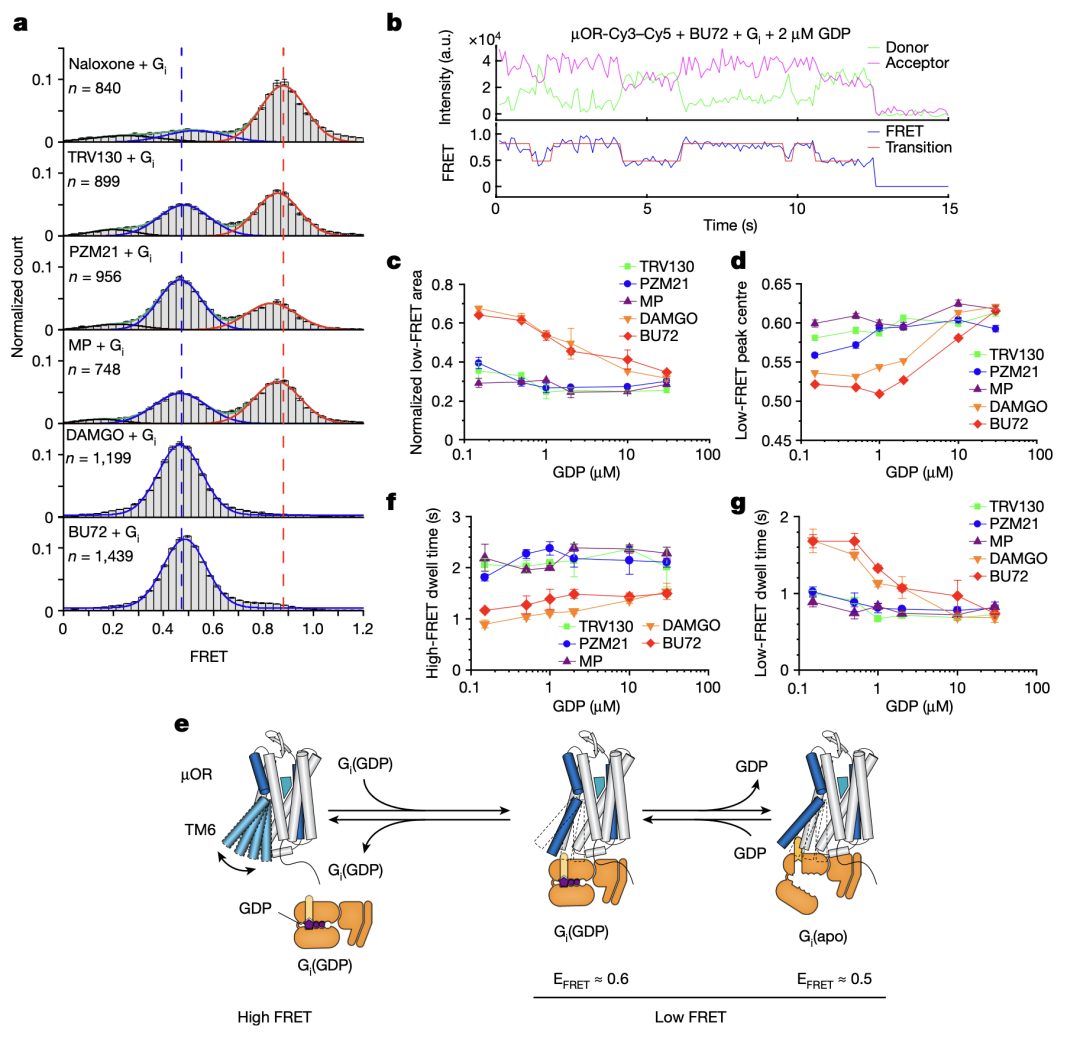
图4.smFRET揭示的µOR的构象变化
该研究不仅提高了科研界对µOR激活机制的理解,也为开发新型的、副作用更小的镇痛药物提供了理论基础。随着对GPCR动态结构和功能之间关系的进一步探索,未来有望开发出更为安全有效的治疗方案,以更好地应对疼痛和其他相关疾病。
清华大学生命科学学院副教授陈春来、斯坦福大学教授布赖恩·科比尔卡(Brian Kobilka)和加州大学洛杉矶分校博士后马蒂亚斯·埃尔盖蒂(Matthias Elgeti,现为莱比锡大学医学院研究员)为论文共同通讯作者;清华大学生命学院清华-北大生命科学联合中心2013级博士生、医学院原博士后赵佳伟(现为哈佛大学医学院博士后)与马蒂亚斯·埃尔盖蒂为论文共同第一作者。清华大学医学院原博士后衡杰和基础医学院博士孙晓鸥参与了研究。研究得到国家自然科学基金委、北京生物结构前沿研究中心、北京结构生物学高精尖创新中心、膜生物学国家重点实验室以及清华-北大生命科学联合中心的支持。
文章来源清华大学新闻,分享只为学术交流,如涉及侵权问题请联系我们,我们将及时修改或删除。
-
2025年智能光子学与应用技术国际学 06-10

-
2025年8月优质学术会议推荐 589

-
2025年第十二届能源与环境研究国际 400

-
2025年机械工程,新能源与电气技术 559

-
2025年计算机科学、图像分析与信号 553

-
2025年材料化学与燃料电池技术国际 493

-
第七届精神病学国际大会(CP 202 08-01

-
第七届老龄化与老年医学国际学术会议( 08-01

-
第十四届心理学与健康国际学术研讨会( 08-01

-
第七届测绘与地理信息国际研讨会(CS 08-01

-
第七届大气与海洋科学国际研讨会(SA 08-01

-
第十一届地质灾害研究与防治国际学术会 08-01

-
第十六届地质和地球物理学国际会议(I 08-01

-
第七届细胞科学与再生医学国际研讨会( 08-01

-
第七届合成生物学与生物医学国际研讨会 08-01

-
2025最新JCR分区及影响因子1939

-
好学术:科研网址导航|学术头条分468

-
《时代技术》投稿全攻略:一位审稿499

-
2025年国际期刊预警名单发布!600

-
2025年中科院期刊分区表重磅发3957

-
中科院已正式发布2024年预警期861

-
2025年度国家自然科学基金项目727

-
中国科协《重要学术会议目录(202733

-
2024年国家自然科学基金项目评1138

-
2024年JCR影响因子正式发布1214

-
吉林大学校长张希:学术会议中的提1391

-
SCI论文插图全攻略:从规范解析08-01

-
国际学术会议参加经验是怎么样的呢08-01

-
掠夺性会议是怎么进行判断的呢?—08-01

-
SCI论文投稿费怎么交?202408-01

-
宁波包豪斯创意文化策划有限公司 22853

-
欧曼展览(上海)有限公司 7868

-
WILL 2050

-
FVDAGWE 2012

-
中国演示版学会 23866

-
武汉cee主办方 18010

-
浙江华夏电子商务有限公司 20921

-
长春市索雅世纪 18092

-
ABS2016组委会 1888

-
佛山市份额无法 17947

-
中国人民大学统计学院 21081

-
天津中豪会议策划服务有限公司 2190

-
桂林中桂商务会议服务有限公司 20925

-
北京大学计算机系 18153

-
湖南会议接待服务中心 24049

-
上海麦峰 22924

-
江西省南昌市 18111

-
IAASE 20835

-
北京 24358

-
中山大学附属第三医院 21034



















 683
683













































